Ensayos
ENTORNOS, Vol. 31, No. 1, Junio 2018
El Enlace Covalente
Juliana Cárdenas Castaño
Universidad Surcolombiana, Colombia
julianacardenas09@gmail.com [Link]
Luis Javier Narváez Zamora
Universidad Surcolombiana, Colombia
ljnz47@usco.edu.co [Link]
Introducción
Este trabajo tiene el propósito de realizar una
conceptualización sobre el proceso de hibridación
o mezcla de orbitales atómicos pertenecientes a
los subniveles de energía
El enlace químico es la fuerza necesaria para mantener dos o más átomos unidos formando compuestos moleculares o cristales iónicos, cualquiera sea el caso, la diferencia entre los valores de electronegatividad de dos átomos comprometidos en un enlace permite establecer el tipo de enlace establecido entre ellos, inicialmente. Pauling (1959, p. 235) planteó el valor 1.9 para asignar cerca del 50% de carácter iónico de un enlace; sin embargo, con el descubrimiento e invención de nuevas sustancias, esta diferencia se ha venido reduciendo hasta 1.6, cifra con la cual se establecen los conceptos involucrados en este artículo. Los valores para el carácter iónico de un enlace se muestran en las tablas No. 1 y tabla No. 2
Tabla No. 1. Carácter iónico porcentual de un enlace simple.
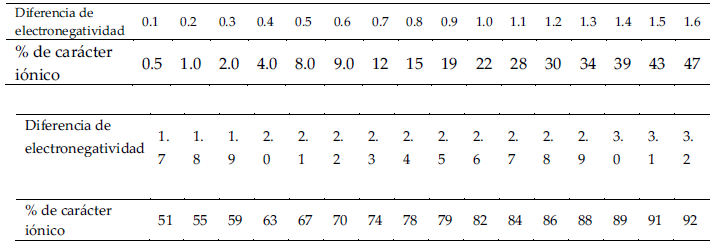
Fuente: Welch, 2014.
Tabla No. 2. Carácter iónico parcial de enlaces y diferencia de electronegatividad de átomos.

Fuente: Pauling, 1959, p. 235.
Para abordar el enlace covalente es preciso
definirlo previamente: un enlace covalente ocurre
cuando un par de electrones son compartidos
por dos átomos. En ese sentido, Chang (2010,
p. 374) lo define como
Para definir el enlace covalente
indefectiblemente debe abordarse el concepto
de hibridación de orbitales atómicos, cuya interacción genera los orbitales moleculares
propios de las moléculas covalentes; en ese
sentido, es pertinente hacer una precisión
importante, es decir que en los enlaces covalentes
de moléculas con octeto están comprometidos
los orbitales propios correspondientes a los
subniveles s y p del último nivel de energía.
Aquellas moléculas con octeto aumentado
o expandido, además de los 4 orbitales
mencionados anteriormente, involucran uno o
dos orbitales del subnivel
A continuación, se describen las interacciones de los electrones presentes en los subniveles mencionados atrás, para constituir el traslape o apantallamiento electromagnético, responsable de los orbitales híbridos.
Orbitales Híbridos
Un orbital atómico es un campo
electromagnético donde existe la probabilidad
de encontrar como máximo un par de electrones
con spin contrario; los orbitales híbridos u
orbitales moleculares resultan de la mezcla
de orbitales atómicos comprometidos en un
enlace, para el caso de moléculas sencillas,
el traslape o mezcla de orbitales resulta una
opción explicativa eficiente, sin embargo, para
moléculas poliatómicas, los orbitales atómicos
se deben mezclar formando orbitales híbridos,
cuyas disposiciones espaciales son diferentes
a las de los orbitales atómicos, así son posibles
varios tipos de hibridación, a saber:
Tabla No. 3. Posibles geometrías moleculares de orbitales moleculares de 2 a 5 orbitales moleculares híbridos
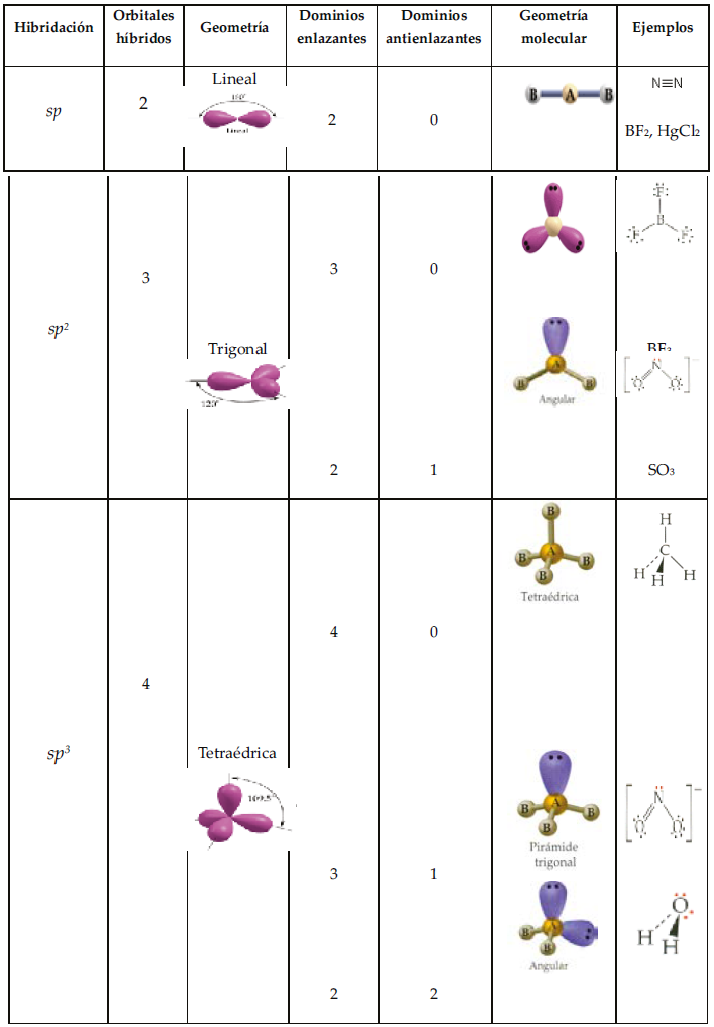
Fuente: Brown, LeMay, Bursten y Burdge. (2004, 324)
Los tipos de hibridación enunciados en la tabla No. 3 requieren un análisis más detallado. En todos los casos, la mezcla, traslape o apantallamiento de orbitales atómicos para formar orbitales moleculares, ocurre de dos maneras bien definidas: todos los orbitales comprometidos en el enlace se traslapan o, al combinarse, quedan uno o más orbitales libres sin llegar a hibridarse. La interacción o traslape de orbitales híbridos explica la formación de enlaces sigma y la interacción electrostática de orbitales no híbridos produce enlaces pi. En cada caso la explicación se aborda a partir de un ejemplo específico, donde además se describen las estructuras de Lewis, explicativas del concepto enlace.
Hibridación sp
Esta hibridación se explicita con una molécula sencilla, en este caso N2. Para determinar la estructura de esta molécula se inicia ubicando al N en el grupo 15 (5A) y una electronegatividad de 3.0; al efectuar la resta se tiene: 3.0 –3.0 = 0 <1.6, esta diferencia de acuerdo con el umbral de Pauling determina el carácter covalente del enlace, con esta clasificación se elaboran las estructuras de Lewis para explicitar el tipo de enlace covalente establecido, tal como se muestra en las gráficas 1a y 1b.
Las dos estructuras determinan el requerimiento de hibridación sp para la molécula N2, tal como se muestra en la gráfica No. 2.
Gráfica No. 2. Orbitales moleculares de N2.
Esta molécula también se puede representar
a través del modelado molecular obtenido del
simulador Chem Sketch, aplicación de
De igual forma, la molécula de nitrógeno se puede representar usando el visor en tres dimensiones de la misma aplicación anterior, ese modelo se presenta en la gráfica No. 3.
Gráfica No. 3. Modelo tridimensional de N2.
Es evidente la formación de un enlace covalente triple entre los dos átomos de nitrógeno, este enlace se explica a través de hibridación
El modelo RPECV (Repulsión del Par
Electrónico de la Capa de Valencia) permite
definirle a la molécula de nitrógeno, dos enlaces
idénticos orientados linealmente; cada átomo
de N
Gráfica No. 4. Estados basal y excitado para el átomo de nitrógeno.
En síntesis, para la ocurrencia del enlace
covalente triple entre los dos átomos, se han
mezclado o hibridado dos orbitales; el
Gráfica No. 5. Hibridación
Una vez enlazados los dos átomos de N
y surtida la hibridación
En la tabla No. 5 se sintetizan los aspectos más importantes de la molécula N2.
Tabla No. 5. Características de la molécula N2
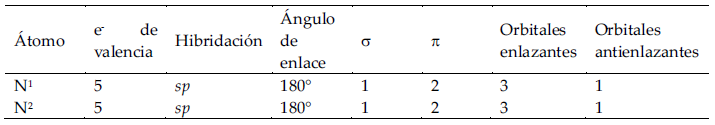
La carga formal como algoritmo para aceptar los diagramas de Lewis construidos para estructuras covalentes se evalúa en la tabla No. 6.
Tabla No. 6. Carga formal de la molécula de N2

Si la carga formal total tiene un valor diferente a cero, la estructura molecular fue mal construida y amerita su revisión exhaustiva.
Hibridación sp2
Hemos escogido la molécula de oxígeno para
explicitar este tipo de hibridación, en la cual se
mezclan tres orbitales: uno de tipo
Gráfica No. 6. Estado excitado del átomo de oxígeno.
En este estado, cada átomo de oxígeno tiene la posibilidad de formar un enlace covalente doble con otro símil. La resta de la electronegatividad 3.5-3.5=0<1.6 confirma el tipo de enlace antes anunciado. Solo resta elaborar las estructuras de Lewis correspondientes, las cuales se muestran en las gráficas 7a y 7b.
La hibridación
Gráfica No. 8. Hibridación
Esta estructura puede representarse también
usando el simulador
Gráfica No. 9. Modelo tridimensional de la molécula de
En la tabla No. 7 se sintetizan los aspectos más importantes de la molécula
Tabla No. 7. Características de la molécula
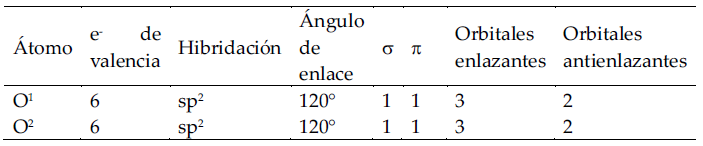
La carga formal como algoritmo para aceptar los diagramas de Lewis construidos para estructuras covalentes se evalúa en la tabla No. 8.
Tabla No. 8. Carga formal de

En la hibridación
Gráfica No. 10. Hibridación
En la gráfica 10 no se incorpora el orbital
Gráfica No. 11. Hibridación
La estructura tridimensional de la molécula se indica en la gráfica No. 12.
Gráfica No. 12. Estructura de la molécula del eteno.
En esta gráfica se evidencian las siguientes características: la molécula es plana como consecuencia de dos situaciones: el enlace sigma ocurrido como solapamiento de los dos orbitales híbridos de cada átomo de carbono enlazado, y por igual, el enlace pi se ubica por encima y por debajo del plano molecular (π/2 por encima y π/2 por debajo de este plano)
Hibridación sp3
Para la hibridación
Por igual, a través del
Gráfica No. 14. Estructura tridimensional de la molécula de agua.
La misma estructura desde la perspectiva de los orbitales moleculares se visualiza en la gráfica No. 15.
Gráfica No. 15. Orbitales moleculares para la molécula del agua.
La hibridación
Gráfica No. 16. Orbitales participantes en de la hibridación
Fuente: Brown,
La mezcla de los cuatro orbitales antes anunciada se denota detalladamente en la gráfica No. 17.
Gráfica No. 17. Detalle de la hibridación
Fuente: Fuente: Brown,
El arreglo final se muestra en la gráfica No. 18.
Gráfica No. 18. Disposición geométrica tetraédrica de la hibridación
Fuente: Fuente: Brown,
La hibridación
Otros ejemplos donde se requiere la
hibridación
En primer lugar, el alcano n-butano con fórmula C4H10, una vez efectuados los cálculos pertinentes para determinar el tipo de enlace y la estructura geométrica, da como resultado lo presentado en las gráficas No. 19 y 20.
Gráfica No. 19. Tipo de hibridación del n-butano Cárdenas Castaño (2017).
Gráfica No. 20. Orbitales moleculares de n-butano Cárdenas Castaño (2017).
Para el caso de moléculas con capas de valencia
expandida, superando los lineamientos de la
ley de octeto, la posibilidad de explicar este
fenómeno se concreta involucrando los orbitales
del subnivel
En el primer caso se producen cinco orbitales
híbridos de tipo
A su vez, la mezcla de un orbital s, con 3 de tipo
p y dos de tipo d, genera seis orbitales híbridos
Moléculas con hibridación mixta
Nos hemos permitido explicitar la naturaleza del enlace covalente basados en el modelo de la hibridación de orbitales atómicos para generar orbitales moleculares, a través de los cuales es posible explicar el enlace covalente sencillo, doble, triple y coordinado o dativo. Sin embargo, las sustancias con moléculas covalentes existen también en la naturaleza con una mixtura de estos enlaces, tal como se evidencia en los casos planteados a continuación.
El alqueno 1-buteno, cuya fórmula molecular
es C4H8 posee hibridación
Gráfica No. 23. Hibridaciones
Gráfica No. 24. Orbitales moleculares del 1-buteno. Cárdenas Castaño (2017)
En cuanto a la estructura molecular del
2-butino, un alquino con hibridación
Gráfica No. 25. Hibridaciones
Gráfica No. 26. Orbitales moleculares del 2-butino. Cárdenas Castaño (2017).
Conclusiones
En síntesis, los autores pretenden efectuar un acercamiento conceptual hacia el mundo submicroscópico del enlace químico de tipo covalente, desde las perspectivas de las teorías de enlace vigentes a través de modelos científicos y mentales, derivados de estudios rigurosos derivados de los planteamientos de Linus Pauling sobre su percepción de la manera como se unen los átomos.
El abordaje teórico del artículo trata de demostrar cómo se unen los átomos, cuando el tipo de enlace es covalente, así mismo, y a manera de conclusión se plantea que las propiedades físicas y químicas de las sustancias químicas con enlace covalentes dependen exclusivamente de su estructura geométrica molecular, la cual a su vez se deriva del tipo de hibridación comprometido en el enlace.
La hibridación es un modelo para explicar los mecanismos electromagnéticos a través de los cuales, los átomos interactúan para establecer enlace covalente, el cual ocurre entre átomos con valores de electronegatividad cuya diferencia sea menor a 1.6; la hibridación en consecuencia es el resultado del apantallamiento o traslape de los orbitales atómicos correspondientes al nivel o capa de valencia, Tal interacción puede ocurrir entre orbitales híbridos para formar interacciones sigma, propias del enlace sencillo, o entre orbitales no híbridos, cuya interacción deriva en interacciones pi, propias de enlaces covalentes doble o triples.
Los tres tipos de hibridación
En próximas oportunidades, los autores abordarán el enlace iónico y el enlace metálico para involucrar átomos cuya posibilidad de enlace es diferente al covalente y así efectuar una mayor cobertura de las moléculas que hacen parte de nuestro vasto universo.
Referencias bibliográficas
ACD Labs. Advanced Chemistry Development. Consultado el 9 de octubre de 2017, disponible en: http://www.acdlabs.com/account/register.php?redirect=/resources/freeware/download.php [Link]
Brown, T., LeMay, E., Bursten, B., & Burdge, J.
(2004).
Cárdenas Castaño, J. (2017).
Chang, R. (2010). Química (Décima ed.). México: Mc Graw Hill.
Narváez Zamora, L. (2009).
Pauling, L. (1959).
Welch, S. (2014).