Rev. Ingeniería y Región, Vol. 19
Nuevos abonos a partir de excrementos de insecto: el caso del
gusano de la harina (Tenebrio molitor )
New fertilizers from insect’s excreta: the mealworm (Tenebrio
molitor) case
Jorge Poveda Arias1
Resumen
El gusano de la harina (
Palabras clave: excrementos; Tenebrio molitor; quitina; microbiota; abono.
Abstract
The mealworm (
Key words: excreta; Tenebrio molitor; chitin; microbiota; fertilizer.
1. Introducción
A la vista de los problemas sanitarios y medioambientales asociados a la masiva y descontrolada utilización de compuestos químicos en la agricultura, se hace necesario buscar nuevas alternativas dentro de los compuestos naturales que puedan ofrecernos los mismos o incluso mejores resultados sin efectos secundarios. En este sentido, los insectos tienen la capacidad de alimentarse de materia orgánica de diferente tipo y producir unos deshechos como resultado de su digestión más fácilmente mineralizables por los microorganismos del suelo y accesibles para las plantas (Shepard & Minshall, 1981; Kagata & Olgushi, 2012).
En el caso del nitrógeno, los insectos son capaces de acumular cantidades significativas en sus excrementos y en una forma fácilmente asimilable por las plantas, aumentando su crecimiento. Pero estos niveles de nitrógeno dependen directamente de su dieta, tal y como ha podido observarse en saltamontes, polillas de la col (
La revisión bibliográfica realizada en este trabajo se ha realizado mediante el uso de bases de datos como Google Scholar o WOS.
2. El gusano de la harina (Tenebrio molitor )
Dentro del orden de los coleópteros o escarabajos (suborden Polyphaga), la familia Tenebrionidae (superfamilia Tenebrionoidea) incluye a más de 20.000 especies en todo el mundo, dentro de las cuales pueden encontrarse unas 200 en la Península Ibérica. Son los denominados escarabajos nocturnos del suelo o escarabajos de las tinieblas o de la oscuridad, y es que su nombre científico proviene del latín
El escarabajo molinero (

Figura 1: Diferentes estadios de desarrollo de
En condiciones ambientales, la hembra puede poner de 300 a 600 huevos durante toda su vida, cuya incubación dura un par de semanas, momento en el que surgen las larvas, que se desarrollarán hasta el otoño, pasando por entre 13 y 20 mudas, manteniéndose en estado de hibernación durante el invierno y comenzando su estadio de pupa en primavera, surgiendo los imagos o adultos en pocas semanas. Por lo tanto, en la naturaleza (siempre ligado al hombre) su ciclo de vida es anual, destacando que temperaturas inferiores a -12ºC y superiores a 41ºC son letales para la especie (Daggy, 1946; Moreno & Álvarez 2005; Argueta-Reyes & Ramos-Meléndez, 2013; Spang, 2013; Park
3. T. molitor como fuente de abono
En relación con la agricultura, el gusano de la harina representa una excelente fuente de abono orgánico procedente de sus deposiciones intestinales (Figura 2), cuya composición dependerá de su alimentación. Diferentes análisis químicos realizados en diferentes muestras han dado como resultado balances de NPK de 3,5-1,5-1,5 (Liu

Figura 2: Fotografía de excrementos de
En su aplicación directa en cultivos se ha observado que la aplicación de este posible abono provoca en cultivos de judía (
2.1. La quitina
Para valorizar aún más la utilización de estas heces como excremento, debemos centrarnos en su proceso de formación. Cuando el alimento pasa a través del intestino medio, el cual carece de cutícula, las células epiteliales segregan una barrera semipermeable denominada membrana peritrófica, que envuelve el alimento y está formada por proteínas (peritrofinas) y quitina. Esta membrana tiene como funciones principales encapsular el alimento y dividirlo en distintas porciones, el aislamiento de toxinas y/o patógenos, y la protección del epitelio intestinal. En su interior ocurre la digestión de las macromoléculas con la entrada de enzimas, la cual libera nutrientes al lumen, donde se completa la digestión y absorción de los mismos (Ramsay, 1964; Weiss, 2006; Moreira, 2013). Por lo tanto, cada hez resulta ser un minúsculo gránulo de materia orgánica parcialmente digerida envuelta por una película quitinosa, con lo cual, todos los beneficios de la utilización de la quitina en la agricultura, descritos a continuación, son directamente aplicables a este abono.
La quitina es un polisacárido de N-acetil-glucosaminas unidas entre sí por enlaces β 1→4, formando cadenas que se unirán paralelamente para formar microfibrillas (Rinaudo, 2006; Prashanth & Tharanathan, 2007; Mármol
En su utilización en agricultura, la quitina presenta numerosos beneficios como:
-
Promotor del crecimiento y desarrollo vegetal , gracias al nitrógeno y los hidratos de carbono que la quitina es capaz de aportar directamente al suelo según se va degradando, a su capacidad para promover el desarrollo de microorganismos beneficiosos, al posible uso del quitosano como anti-transpirante en suelos agrícolas donde la pérdida excesiva de agua es indeseable, o como hidrogeles absorbentes de agua, debido a su alto peso molecular y a su estructura porosa, además, en presencia de quitosano, la planta aumenta la síntesis de las hormonas ácido abscísico (ABA) y ácido jasmónico (JA), ambas relacionadas con la regulación en la apertura de los estomas, aunque pruebas realizadas con mutantes en ambas hormonas siguen respondiendo a la presencia de quitosano con el cierre de los estomas (Bittelliet al. , 2001; Sharp, 2013). -
Fitofortificante frente a estreses abióticos , gracias a la actividad del quitosano como antioxidante, dándole la capacidad de secuestrar radicales hidroxilo, peróxido de hidrógeno y anión superóxido, implicados en estreses de carácter abiótico en las plantas. Por lo que se refiere a la contaminación, la quitina y sus derivados son capaces de formar complejos con iones elementales no-nutrientes, como los metales pesados, pudiendo tratar suelos y fuentes de agua contaminados para remediarlos. También es efectivo contra otros contaminantes artificiales de aguas y suelos como pueden ser los tintes, los hidrocarburos, los fertilizantes y los pesticidas químicos (Sharp, 2013). -
Biopesticida antifúngico , ya que el quitosano actúa de igual forma que cuando las enzimas hidrolíticas de las plantas atacan de forma natural a los hongos patógenos y sus células liberan quitosano al romperse su quitina, el cual penetra en sus núcleos interfiriendo con la correcta síntesis de ARN y proteínas (Duttaet al. , 2009; Ramírezet al. , 2010; Duttaet al. , 2012). Además, los grupos amino libres, cargados positivamente en medios ácidos, como el de la rizosfera, interaccionan con los extremos negativos de las macromoléculas expuestas de la pared celular de los hongos, modificando la correcta permeabilidad de su membrana plasmática y, por lo tanto, alterando sus funciones principales (Velásquez, 2008; Ramírezet al. , 2010). -
Biopesticida antibacteriano , debido a que el quitosano forma un complejo polielectrolito con la membrana celular externa de bacterias Gram negativas, impidiendo la entrada de nutrientes y la salida de deshechos, provocando la muerte bacteriana, mientras que en las bacterias Gram positivas lo que ocurriría sería la entrada del quitosano por los poros de la membrana hasta el núcleo, impidiendo la síntesis de ARN y proteínas (Velásquez, 2008). -
Biopesticida nematicida , debido a que la presencia de quitina en el suelo favorece el desarrollo de microorganismos quitinolíticos que parasitan los huevos de los nematodos y destruyen la quitina presente en la cutícula de los juveniles, y a que la degradación de la misma produce como residuo amoniaco gaseoso que, al acumularse en determinados niveles, tiene efecto directo nematicida (Velásquez, 2008; Ramírezet al. , 2010; Sharp, 2013). -
Inductor de resistencia , gracias a que el quitosano es percibido por la planta como la presencia de un hongo patógeno o un insecto fitófago, por lo que pre-activa sus defensas vegetales frente a ese tipo de peligros (Kakuet al. , 2006; Velásquez, 2008; Enríquez-Guevaraet al. , 2010; Sharp, 2013). -
Favorecedor de relaciones simbióticas , debido a que la quitina favorece el crecimiento y desarrollo de microorganismos antagonistas de fitopatógenos, comoTrichoderma oBeauveria bassiana , mejora la capacidad de rhizobacterias para entrar en simbiosis con leguminosas y de los hongos micorrícicos, al promover su crecimiento micelar (Ramírezet al. , 2010; Sharp, 2013).
2.2 Su microbiota
Es ampliamente sabido que los insectos atesoran una variadísima microbiota intestinal muy beneficiosa para ellos. Dentro de esta microbiota,
-
Paenibacillus sp. es un género de bacterias con un gran interés en agricultura, ya que se incluyen dentro de las denominadas como bacterias promotoras del crecimiento vegetal (PGPRs), al mejorar el aporte de nitrógeno a la planta, la absorción de potasio, calcio y magnesio, la solubilización de fosfatos, la producción de sideróforos y de auxinas, y la tolerancia frente a estreses abióticos por metales pesados, sequía y salinidad; además, presenta actividad antifúngica contra hongos fitopatógenos comoCollecotrichum goleosporoides, Fusarium oxysporum, Botrytis cinerea, Phytophthora capsici o Rhizoctonia solani , bacterias comoPectobacterium caratovorum , y nematodos comoMeoidogyne incognita ; e incluso es capaz de degradar pesticidas organofosforados presentes como residuos en los suelos (Zhanget al. , 2013; Romeh & Hendawi, 2014; Silvaet al. , 2015; Seoet al. , 2016; Xieet al. , 2016). -
Bacillus sp., género de bacterias PGPRs cuya representante más conocida esB. thuringiensis , debido a su capacidad para sintetizar una proteína insecticida muy eficaz. Pero existen otras especies capaces de estimular la germinación y el crecimiento de las plántulas , fijar el nitrógeno atmosférico, producir sideróforos, solubilizar fosfatos, y producir auxinas que favorecen la formación de raíces por las plantas, además es capaz de inducir en la planta una resistencia sistémica frente al ataque de plagas y patógenos, e incluso tiene acción directa antifúngica contraFusarium graminearum (Figura 3),F. incarnatum, Collecotrichum acutatum yC. goleosporoides , antibacteriana contraRalstonia solanacearum , nematicida contraMeloidogyne incognita y supresor del protista causante de la hernia de la col,Plasmodiophora brassicae (Penget al. , 2013; Zhaoet al. , 2014; Ab Azizet al. , 2015; Han & Kim, 2015; Kauret al. , 2015; Widnyana & Javandira, 2016). -
Rhizobium sp., es el género de bacterias PGPRs más estudiado (Figura 4), son capaces de fijar el nitrógeno atmosférico, solubilizar fosfatos, producir auxinas y sideróforos, además, una vez que han conformado su relación simbiótica con las leguminosas a las que les aportan estos beneficios, son capaces de liberar cianuro de hidrógeno en forma gaseosa al suelo, impidiendo el crecimiento cercano de malas hierbas, e incluso son capaces de inducir en la planta una resistencia sistémica frente a diferentes patógenos (Babaet al. , 2015; Singhet al. , 2015). Por otro lado, son capaces de inducir en las plantas tolerancia frente a estrés salino (Elsheikh, 2015) y sequía (Rasaeiet al. , 2013; Beshiret al. , 2015).
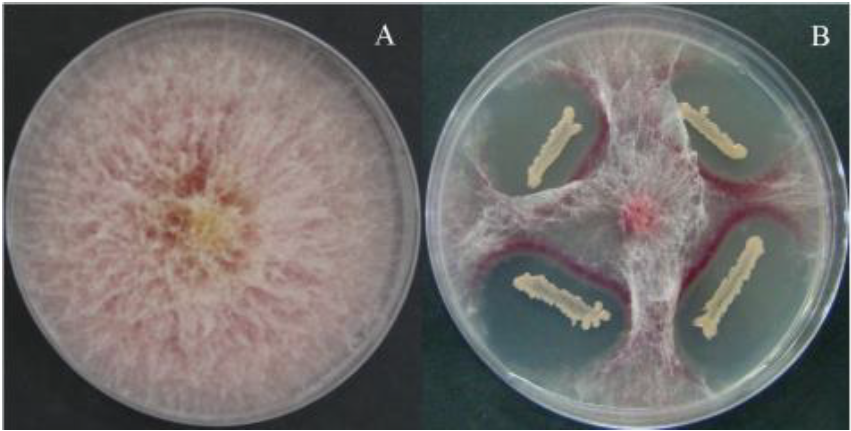
Figura 3: Efecto antifúngico de

Figura 4: Efecto de promoción del crecimiento de
El papel de la microbiota presente en los excrementos de
3. Conclusiones
Los excrementos de los insectos representan un buen aporte de nutrientes para las plantas. En el caso de
4. Referencias Bibliográficas
Ab Aziz, Z. F., Saud, H. M., Kundat, F. R., Jiwan, M., & Wong, S. K. 2015. Rhizobacterium Bacillus cereus induces root formation of pepper (
Argueta-Reyes, L. & Ramos-Meléndez, G.K. 2013. Contenido de Proteína, Grasa, Calcio, Fósforo en larvas del escarabajo molinero (Coleoptera: Tenebrionidae:
Baba, Z. A., Aziz, M. A., Sheikh, T. A., Sheikh, F. A., Bhat, Z. A., Khan, S., & Hamid, B. 2015. Studies on soil health and plant growth promoting potential of
Barrientos, J.A. 2004. Curso práctico de entomología (Vol. 41). Univ. Autónoma de Barcelona.
Beshir, H. M., Walley, F. L., Bueckert, R., & Tar'an, B. 2015. Response of snap bean cultivars to
Bittelli. M., Flury, M., Campbell, G.S., Nichols, E.J. 2001. Reduction of transpiration through foliar application of chitosan. Agricultural and Forest Meteorology, 107: 167-175.
Chinery, M. 1997. Guía de campo de los insectos de España y de Europa. Editorial Omega.
Chinery, M. 2001. Guía de los insectos de Europa. Editorial Omega.
Daggy, T. 1946. Notes on the ecology and taxonomy of certain pupae of the family Tenebrionidae (Coleoptera). Proceedings of the Indiana Academy of Science, 56: 253-260.
Dierl, W. & Ring, W. 1995. Insectos de España y de Europa: identificación, hábitat, biología. Editorial Omega.
Dutta, J., Tripathi, S., Dutta, P.K. 2012. Progress in antimicrobial activities of chitin, chitosan and its oligosaccharides: a systematic study needs for food applications. Food Science and Technology International, 18: 3-34.
Dutta, P.K., Tripathi, S., Mehrotra, G.K., Dutta, J. 2009. Perspectives for chitosan based antimicrobial films in food applications. Food Chemistry, 114: 1173-1182.
Elsheikh, E. A. 2015. Response of legume-
Enríquez-Guevara, E.A., Aispuro-Hernández, E., Vargas-Arispuro, I., Martínez-Téllez, M.Á. 2010. Oligosacarinas Derivadas de Pared Celular: Actividad Biológica y Participación en la Respuesta de Defensa de Plantas. Revista Mexicana de Fitopatología, 28:144-155.
Escaso, F., Narváez, I., Planelló, M.R., Rueda, M.J., Herrero, O. 2015. Manual de Entomología Aplicada. Sanz y Torres-UNED.
Ferguson, B. J. 2013. The development and regulation of soybean nodules. INTECH Open Access Publisher.
Fernández Rubio, F., Moreno Fernández-Caparrós, L., Soriano, Ó. 2014. Artrópodos en medicina y veterinaria. Ministerio de Defensa de España.
Fielding, D. J., Trainor, E., & Zhang, M. 2013. Diet influences rates of carbon and nitrogen mineralization from decomposing grasshopper frass and cadavers. Biology and Fertility of Soils, 49(5), 537-544.
Gao Y (2011). 黄粉虫粪营养成分的测定与分析 (Measurement and analysis Tenebrio faecal nutrients). 黑龙江畜牧兽医: 下半月, (3).
García-Serrano, P., Ruano, S., Marotta, J., & Nogales, M. 2010. Guía práctica de la fertilización racional de los cultivos en España. Parte I. Gobierno de España. Ministerio del Medio Ambiente y Medio Rural y Marino. España.
Goswami, D., Parmar, S., Vaghela, H., Dhandhukia, P., & Thakker, J. N. 2015. Describing
Han, J. H., & Kim, J. O. 2015. D-6: Biological Control of Anthracnose (
Howard, R.S. (955. The biology of the grain beetle
Juan, C. & Petitpierre, E. 1991. Evolution of genome size in darkling beetles (Tenebrionidae, Coleoptera). Genome, 34: 169-173.
Julca-Otiniano, A., Meneses-Florián, L., Blas-Sevillano, R., Bello-Amez, S. 2006. La materia orgánica, importancia y experiencia de su uso en la agricultura. Idesia, 24: 49-61.
Jung, J., Heo, A., Park, Y.W., Kim, Y.J., Koh, H., Park, W. 2014. Gut microbiota of
Kagata, H., & Ohgushi, T. 2012. Positive and negative impacts of insect frass quality on soil nitrogen availability and plant growth. Population Ecology, 54(1), 75-82.
Kaku, H., Nishizawa, Y., Ishii-Minami, N., Akimoto-Tomiyama, C., Dohmae, N., Takio, K., Shibuya, N. 2006. Plant cells recognize chitin fragments for defense signaling through a plasma membrane receptor. Proceedings of the National Academy of Sciences, 103: 11086-11091.
Kaur, H., Kaur, H., & Rishi, P. 2015. Bare-root-dip treatment of tomato seedlings with neem and
Li, L., Xie, B., Dong, C., Wang, M., Liu, H. 2016. Can closed artificial ecosystem have an impact on insect microbial community? A case study of yellow mealworm (
Li, L., Zhao, Z., Liu, H. 2013. Feasibility of feeding yellow mealworm (
Liu, H., Yang, Z., Tan, D., & Wu, Z. 2002. Study on the fertilizer efficiency of the frass of
Luo, H. Y., Wang, H., & Wang, Q. 2011. Effects of Different Application Amount of Yellow Mealworm Excrement on Growth and Quality of Rape. Shandong Agricultural Sciences, 8, 026.
Mármol, Z., Páez, G., Rincón, M., Araujo, K., Aiello, C., Chandler, C., & Gutiérrez, E. 2013. Quitina y Quitosano polímeros amigables. Una revisión de sus aplicaciones/Chitin and Chitosan friendly polymer. A review of their applications. Revista Tecnocientífica
Medvedev, G.S. & Iwan, D. 2006. Notes on the taxonomy of tenebrionid beetles (Coleoptera: Tenebrionidae). Annales Zoologici, 56: 613-621.
Mishra, A., Afik, O., Cabrera, M. L., Delaplane, K. S., & Mowrer, J. E. 2013. Inorganic nitrogen derived from foraging honey bees could have adaptive benefits for the plants they visit. PloS one, 8(7), e70591.
Mishra, P. K., Bisht, S. C., Mishra, S., Selvakumar, G., Bisht, J. K., & Gupta, H. S. 2012. Coinoculation of Rhizobium leguminosarum-PR1 with a cold tolerant
Moreira, N.R. 2013. Fisiologia molecular intestinal de Tenebrio molitor. Doctoral dissertation, Universidade de São Paulo.
Moreno, A.A. & Alvarez, C.S. 2005. Entomología agraria: los parásitos animales de las plantas cultivadas. Diputación Provincial de Soria.
Park, J.B., Kim, S.H., Han, Y.S., Kim, N.J. 2014. Developmental characteristics of
Peng, G., Pageau, D., Strelkov, S. E., Lahlali, R., Hwang, S. F., Hynes, R. K., & Falk, C. K. 2013. Assessment of crop rotation, cultivar resistance and
Poveda, J. 2015. Mealfrass: Utilización de excrementos del gusano de la harina (
Poveda, J. 2017. Mealfrass III: Utilización de excrementos del gusano de la harina (
Prashanth, K.H. & Tharanathan, R.N. 2007. Chitin/chitosan: modifications and their unlimited application potential - an overview. Trends in Food Science & Technology, 18: 117-131.
Ramírez, M.A., Rodríguez, A.T., Alfonso, L., Peniche, C. 2010. Chitin and its derivatives as biopolymers with potential agricultural applications. Biotecnología Aplicada, 27: 270-276.
Ramsay, J.A. 1964. The rectal complex of the mealworm
Rasaei, B., Ghobadi, M. E., Ghobadi, M., & Najaphy, A. 2013. Reducing effects of drought stress by application of humic acid, mycorrhiza and
Rinaudo M (2006). Chitin and chitosan: properties and applications. Progress in Polymer Science, 31: 603-632.
Romeh, A. A., & Hendawi, M. Y. 2014. Bioremediation of certain organophosphorus pesticides by two biofertilizers,
Seo, D. J., Lee, Y. S., Kim, K. Y., & Jung, W. J. 2016. Antifungal activity of chitinase obtained from
Sharp, R.G. 2013. A review of the applications of chitin and its derivatives in agriculture to modify plant-microbial interactions and improve crop yields. Agronomy, 3: 757-793.
Shepard, R. B., & Minshall, G. W. 1981. Nutritional value of lotic insect feces compared with allochthonous materials. Archiv fur Hydrobiologie.
Silva, V. N. D., Silva, L. E., da Silva, A. J., & Macedo, G. R. D. 2015. Biofertilizers and performance of
Singh, A. D. R. K., Kumar, S., & Kumar, S. 2015. An effective and beneficial plant growth promoting soil bacterium “
Spang, B. 2013.
Stoops, J., Crauwels, S., Waud, M., Claes, J., Lievens, B., Van Campenhout, L. 2016. Microbial community assessment of mealworm larvae (
Triplehorn, C.A.J., Borror, N.F., Triplehorn, D.J.C.A., Johnson, N.F. 2005. Introduction to the study of insects. Thomson-Brooks.
Velásquez, C.L. 2008. Algunas potencialidades de la quitina y el quitosano para usos relacionados con la agricultura en Latinoamérica. Revista UDO Agrícola, 8: 1-22.
Waewthongrak, W., Pisuchpen, S., & Leelasuphakul, W. 2015. Effect of
Wang, Y. & Zhang, Y. 2015. Investigation of Gut-Associated Bacteria in
Widnyana, I. K., & Javandira, C. 2016. Activities
Xie, J., Shi, H., Du, Z., Wang, T., Liu, X., & Chen, S. 2016. Comparative genomic and functional analysis reveal conservation of plant growth promoting traits in
Younes, I., & Rinaudo, M. 2015. Chitin and chitosan preparation from marine sources. Structure, properties and applications.
Zhang, M.I., Tan, T., Yuan, H., Rui, C. 2003. Insecticidal and fungicidal activities of chitosan and oligo-chitosan. Journal of Bioactive and Compatible Polymers, 18: 391-400.
Zhang, A. M., Zhao, G. Y., Gao, T. G., Wang, W., Li, J., Zhang, S. F., & Zhu, B. C. 2013. Solubilization of insoluble potassium and phosphate by
Zhao, Y., Selvaraj, J. N., Xing, F., Zhou, L., Wang, Y., Song, H., & Liu, Y. 2014. Antagonistic action of
1 Biólogo (18.533-CL) e Investigador Predoctoral de Mealfood Europe S.L. Doctorados Industriales (MINECO) (DI-15-07460). Programa de Doctorado en Ingeniería de Biosistemas (RD 99/2011), Universidad de León. jorgepoveda@mealfoodeurope.com [Link]