En el tratamiento biológico de aguas residuales participan diversos microorganismos entre los que se encuentran las bacterias filamentosas. El crecimiento excesivo e incontrolado de estos microorganismos genera problemas asociados al esponjamiento de los fangos conocido como bulking y la formación de espumas o foaming. La correcta identificación de estos organismos tiene un papel importante en la toma de decisiones para la correcta operación de las plantas de tratamiento de agua residual. Los tratamientos anaerobios empleados para el tratamiento de aguas residuales urbanas e industriales, con un contenido alto de sulfatos en el afluente, generan efluentes que contienen concentraciones importantes de sulfuro que bajo determinadas condiciones pueden favorecer la aparición de organismos filamentosos. En este trabajo se usan técnicas microbiológicas convencionales y moleculares para la identificación de bacterias filamentosas (Thiothrix) asociadas a un problema de decantación en un sistema de fangos activados que trata el agua efluente de un reactor anaerobio de membranas sumergidas (SAnMBR) con concentraciones elevadas de sulfuro (105 ± 10 mg S-L-1). En este estudio se comparan dos periodos de operación con el fin de determinar la influencia del tiempo de retención hidráulico (TRH) sobre la proliferación de las bacterias filamentosas Thiothrix.
Palabras clave: Bacterias filamentosas, bulking, fango activado, sulfuro, Thiothrix.
In wastewater treatment, bulking and foaming are problems associated with filamentous bacteria The identification of these organisms has an important role in decision-making in the operation of waste water treatment plants. Anaerobic treatments used for the treatment of urban and industrial wastewater with high sulfate content give rise to effluents containing significant concentrations of sulfur which under certain conditions may favour the filamentous organisms development. In this work, conventional and molecular microbiological techniques have been used to identify filamentous bacteria (Thiothrix) associated with a sedimentation problem in an activated sludge system treating the effluent of submerged anaerobic membrane bioreactor (SAnMBR) containing high concentrations of sulphide (105 ± 10 mg S-L-1). This study also compares two operational periods and determines the influence of HRT in the process.
Keywords: Activated sludge, bulking, foaming, sulphide, Thiothrix.
En la actualidad se emplean diversos procesos para el tratamiento de las aguas residuales urbanas, uno de los más habituales es mediante el uso de reactores anaerobios, siendo los más utilizados los reactores UASB y los reactores anaerobios de membranas. La combinación de reactores anaerobios con procesos de filtración con membranas tienen una serie de ventajas frente a otros tratamientos. Entre estas ventajas destaca la producción de biogás que permite el aprovechamiento energético del agua residual, y la menor generación de fangos. Sin embargo, el efluente de un tratamiento anaerobio contiene concentraciones de nitrógeno y fósforo similares a las del agua residual afluente; concentraciones moderadas de materia orgánica biodegradable; y concentraciones importantes de sulfuro y metano disuelto (Giménez et al., 2011; Khan et al., 2011). Por tanto, se hace necesario un tratamiento posterior para eliminar estos nutrientes con el fin de hacer posible la reutilización del agua tratada o su vertido al medio natural. Las características del efluente de un SAnMBR lo hacen susceptible de ser tratado mediante tratamientos convencionales como el sistema de fangos activados con eliminación biológica de nutrientes.
En los sistemas de fangos activados se pueden encontrar diversos microorganismos en función de los procesos que se lleven a cabo (nitrificación, desnitrificación, eliminación biológica de fósforo). Dentro de los microorganismos comúnmente encontrados en los reactores biológicos están las bacterias filamentosas. Una baja proporción de bacterias filamentosas puede ser beneficiosa para la formación del floculo, pero un crecimiento excesivo de este tipo de microorganismos puede generar diversos problemas que provocan una desestabillzación del floculo dificultando el proceso de separación o decantación de la biomasa en los decantadores (lenkins et al., 1993).
El primer aspecto importante para el control de bacterias filamentosas es identificar el tipo de bacteria filamentosa presente, con el fin de establecer rápidamente las condiciones más desfavorables para su crecimiento.
En los años setenta Eikelboom (2000) clasificó diversos grupos de bacterias filamentosas en función de las características morfológicas comunes y de las respuestas a tinciones simples (para detectar PHB, gránulos de azufre, etc.). Esta forma de identificación no es especifica ya que pueden existir bacterias genéticamente distintas y morfológicamente muy similares.
Actualmente se emplean técnicas moleculares basadas en el análisis del ARN y del ADN aplicadas al tratamiento biológico de aguas residuales. Una de las técnicas comúnmente empleada para la identificación de bacterias es la técnica FISH (Fluorescent in situ hybridization) basada en la hibridación directa de la bacteria sobre una región del gen 16s ARNr o 23s ARNr (Amman et al., 1995). La utilización de esta técnica permite, mediante sondas marcadas con tluorocromos que se unen a una parte del gen 16s del microorganismo, identificar el nivel taxonómico al que pertenece. El íluorocromo emite una señal fluorescente en las bacterias que hibrida con la sonda. El empleo de esta técnica comparada con las técnicas convencionales resulta más fiable teniendo en cuenta que se basa en secuencias de nudeóti-dos específicos.
El estudio presentado en este trabajo se ha realizado en una planta piloto de fangos activados que trata el efluente de un reactor anaerobio de membranas sumergidas (SAnMBR) caracterizado por presentar una alta concentración de sulfuro (Sánchez-Ramirez et al., 2012). Este trabajo describe un episodio de proliferación de bacterias filamentosas en dicha planta piloto y también describe la identificación realizada mediante técnicas microbiológicas convencionales y moleculares de la bacteria filamentosa Thiothrix. También compara dos periodos experimentales a TRH distintos con el fin de determinar la influencia de este parámetro sobre la proliferación de las Thiothrix.
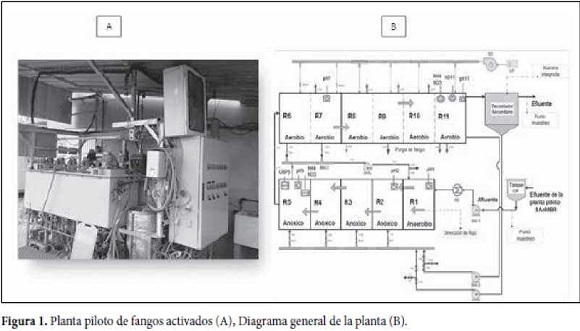
El estudio se realizó en una planta piloto de fangos activados ubicada en la EDAR de la Cuenca del Carraixet, situada en Valencia, España. La planta piloto trataba el efluente de un reactor SAnMBR (Giménez et al., 2011). La planta piloto, operada mediante una configuración UCT (University of Cape Town), constaba de un reactor biológico de 800 L subdividido en 3 zonas (Anaerobia-Anóxica-Aerobia) y un decantador secundario de 80 L (Figura. 1). Durante los periodos estudiados la planta piloto fue operada a dos tiempos de retención hidráulico (TRH): 13 y 26 h correspondientes a un caudal afluente de 60 y 34 Lh', respectivamente. El tiempo de retención celular (TRC) fue mantenido en tomo a 25 d en ambos periodos. La temperatura oscilo entre 13 y 24 °C. La concentración de sólidos suspendidos en el sistema se situó en torno a 1350 mg-L*. Asi mismo, la concentración de oxigeno disuelto (OD) osciló entre 1,0 y 2,5 mg-L ‘ en ambos periodos.
Las características medias del efluente del SAnMBR son: baja DQO biodegradable (30 ± 8 mg DQO-L'), que corresponde en un 90% a ácidos grasos volátiles (AGV); elevadas concentraciones de nutrientes (55 ± 9 mg N-NH( L *, 7 ± 2 mg P-PO( L1, 105 ± 10 mgS 2 L ‘); y una concentración de metano disuelto de 43 ± 10 mg DQOL1.
Las técnicas analíticas utilizadas en este trabajo corresponden a las descritas en el Standard .Methods (APHA, 2005) para la determinación de sólidos suspendidos totales, sólidos suspendidos volátiles, IVF, amonio (N-NH4) y sulfuro (S-S2). Para la determinación de la alcalinidad y los ácidos grasos volátiles (AGV) se empleó el método de valoración ácido-base propuesto por Moosbrugger et al., 1992. El metano disuelto fue calculado a partir de la medida de metano en el biogás y el equilibrio entre fases empleando la ley de Henry. El metano en el biogás fue medido empleando un analizador continuo de gases (X-Stream X2, Emerson).
Las muestras analizadas para la identiñcación y cuantificación de los microorganismos de Interés fueron tomadas al final de la etapa aerobia. Para la observación se utilizó un microscopio de epifluoresencia DM2500 con cámara digital DFC420c. En la aplicación de la técnica FISH se emplearon las sondas que se muestran en la Tabla 1. La sonda general empleada para la hibridación del dominio eubacteria fue la sonda (EUBMIX) compuesta por tres sondas EUB 338, EUBII 338 y EUBIII 338 (Amann et al., 1990; Daims et al., 1999) que hibridan sobre bacterias, planctomyce-tales y verrucomicrobiales. Para la determinación de las bacterias filamentosas se empleó una sonda especifica que hibrida sobre bacterias Thiothrix (Eikelboomii, nivea, unzii, fructosivorans, deflu-vii, eikelboom 021N grupo I,Il,III). Cada sonda especifica es obtenida según el nivel taxonómico, phylum, clase, familia, género y especie (Amann fí al., 1995),
Para la cuantificación se utilizó un programa desarrollado en Matlab (Borrás, 2008). Este programa permite realizar el tratamiento de las imágenes obteniendo el área ocupada de la señal en pételes. El software realiza un recuento de bs pixeles y compara el área de la señal obtenida con la sonda específica y con la sonda general EUBMIX (Tabla 1). El resultado final del recuento se expresa en porcentaje.
Este estudio fue divido en dos periodos a lo largo de los cuales se ha modificado el TRH con el fin de disminuir la carga de sulfuro y la cantidad de AGV al sistema. En ambos periodos se han mantenido constantes el resto de parámetros opera-cionales. Los resultados obtenidos permitieron comparar la influencia del TRH sobre la proliferación de las bacterias filamentosas Thiothrix.
La puesta en marcha de la planta piloto de fangos activados durante el periodo I se Inició inoculando el sistema con 200 L de biomasa procedente del reactor industrial de fangos activados de la EDAR de la Cuenca del Carraixet. En el primer periodo, se fijaron como condiciones de operación un TRC de 25 d, un TRH de 13 h (Q_. . ~ 60 L-h ‘), manteniéndose la temperatura media entre 24°C al inicio del periodo y 12°C al final (Figura. 2 A). Las recirculaciones internas mantuvieron una relación de 2 con respecto al caudal de entrada. Al inicio de este periodo de operación se observó una decantación adecuada, alcanzando valores del indice volumétrico del fango (IVF) de 200 ml-mg1 y valores de sólidos suspendidos en el efluente de 15 mgL1, siendo este parámetro indicativo de la buena decantación del fango. Pasados 120 dias de operación, la decantación comenzó a verse afectada alcanzándose concentraciones de sólidos suspendidos en el efluente de 262 mg L1 (Figura. 2B) y observándose el manto de fango muy próximo al vertedero del decantador, fenómeno característico de un bulking de filamentos. En la Figura 3B se puede observar el aspecto del decantador al inicio del periodo experimental y durante la proliferación de las filamentosas.
Con el fin de descartar que este deterioro estuviera asociado a un mal funcionamiento del decantador al caudal de operación fijado (60 L-h '), se verificó la carga de sólidos y la carga superficial del decantador obteniéndose valores de 0.58 kg SSm 2-h ‘y 0.43 m-'m 2-hrespectivamente. Se observó que ambos parámetros se encontraban dentro de los valores de diseño recomendados para un decantador secundario.
Durante este periodo se presentaron algunos fallos operacionales que dejaron al sistema sin afluente y sin aireación, dando origen a un sistema biológico pobremente aireado, cuyas condiciones favorecen el crecimiento de algunas bacterias filamentosas. El deterioro en la calidad del efluente coincidió con un aumento de la concentración de ácidos grasos volátiles (AGV) en la entrada al sistema biológico, donde se observaron concentraciones de hasta 130 mg DQO L1 (Figura. 4).
El problema del bulking fue cada vez más severo hasta el punto que las bacterias filamentosas dominaron el sistema. Este deterioro en la decantación fue observado en los ensayos de V realizados, donde se obtuvieron valores de IVF en torno a 400 mL-mg-1, valor asociado a problemas de bulking (Pujol et al., 1990).
Teniendo en cuenta el deterioro de la decantación observado, se intensificó el seguimiento mi-crobiológico del fango con el fin de determinar cuál era la bacteria filamentosa causante de este problema. Al visualizar el fango en contraste de fases se observó que la bacteria filamentosa formaba redes interfloculares con formas alargadas, observando una rápida proliferación de las mismas frente al resto de microorganismos presentes (Figura. 6A).
Las bacterias Thiothrix presentan formas diversas con tamaños que varían entre los 0,6 - 2,5 pm con pequeñas células rectangulares en su interior y pequeños granulos de azufre en su interior (Unz y Head., 2005). Las Thiothrix pertenecen a un género de bacterias capaces de oxidar compuestos de azufre y almacenarlos dentro de la membrana celular. Por lo general son bacterias gram negativas (G ) pero también pueden encontrarse otras clasificaciones (Wagner et al., 1994).
Mediante la técnica convencional de contraste de fases fue posible observar bacterias filamentosas que presentaban pequeños granulos amarillos en su interior característicos de las bacterias filamentosas Thiothrix (Figura 6D). Los granulos amarillos observados corresponden presuntamente al azufre acumulado intracelularmente.
Con el objetivo de verificar si la bacteria filamentosa observada correspondía a la especie Thíothrix, se empleó la técnica FISH. Esta técnica permitió identificar mediante la hibridación con una sonda especifica (Tabla 1) que el tipo de bacteria filamentosa presente correspondía claramente a la especie Thiothrix con una abundancia de un 18 ± 2% (Figura. 7).
Al final del periodo I, el sistema se deterioró debido a la perdida excesiva de sólidos por el decantador. Teniendo en cuenta que el afluente proviene de un sistema anaerobio de membranas sumergidas y no contiene sólidos suspendidos que pueda inocular el sistema, se decidió iniciar con una nueva siembra y evaluar la influencia del TRH sobre la proliferación de estos organismos.
Las recomendaciones de algunos autores para controlar el crecimiento de bacterias filamentosas Thiothrix están basadas en la disminución de las concentraciones de sulfuras y de AGV en el sistema (Jenkins et al., 2004; Lemmer et al., 2000). Teniendo en cuenta que el afluente tratado en este estudio contiene concentraciones importantes de sulfuro (105 mg S-L*) y en ocasiones concentraciones punta de AGV (hasta 130 mg DQO L1) que favorecen el crecimiento excesivo de las bacterias Thiothrix, se hace necesario disminuir la carga de sulfuro y AGV al sistema. La carga de estos compuestos al sistema puede realizarse mediate la modificación del TRH. Los resultados de este cambio se muestran en el periodo II.
El periodo II se inició inoculando la planta piloto con 200 L de biomasa procedente del reactor industrial de fangos activados de la EDAR de la Cuenca del Carraixet. Se fijaron como condiciones de operación un TRC en torno a 25 d y un TRH de 26 h (Q,^,^.,- 30 L h l). La temperatura se mantuvo entre 22°C al inicio del periodo y 13“C al final (Figura. 8). La concentración de sulfuro y AGV se mantuvo en torno a 109 mg S-L1 y 77 mg-L1 respectivamente. Las reclrcula-ciones internas se mantuvieron igual que durante el periodo I. El seguimiento microbiológico fue llevado a cabo de forma continua con el fin de identificar rápidamente la posible proliferación de las bacterias filamentosas Thiothrix.
Tal y como se muestran en las figura 8, durante este periodo los sólidos suspendidos en el efluente se mantuvieron en torno a 23 mg-L1 y la operación del decantador fue normal. Durante este periodo se observó una mejora importante en el proceso de decantación. Teniendo en cuenta que los parámetros operacionales se mantuvieron constantes en ambos periodos, el aumento del TRH a 26 h en el periodo II, favoreció la formación de flóculos estables y la disminución de bacterias filamentosas. Es decir el aumento del TRH en este proceso es un parámetro determinante y de gran influencia sobre la proliferación de las bacterias filamentosas Thiothrix.
La mejora observada en el periodo II, es atribuida a la disminución de la carga de sulfuro y de los AGV al sistema, ya que el funcionamiento hidráulico del decantador no estaba comprometido tal y como se ha comentado anteriormente. En concordancia con algunos autores, para controlar la proliferación de bacterias filamentosas Thiothrix es necesario disminuir la disponibilidad de sulfuro y AGV al sistema, teniendo en cuenta que estos componentes actúan como sustrato para este tipo de microorganismos.
Durante este periodo y con el fin de comprobar la abundancia de las bacterias filamentosas se realizó el seguimiento microbiológico a lo largo del tiempo de operación mediante contraste de fases Figura 8. Evolución de la temperatura y el caudal influente durante el periodo II (C). Evolución de los sólidos en el reactor (RAE) y en el efluente (D). y la técnica ElSH. Según lo observado en nJnguna muestra se presentó un crecimiento excesivo de bacterias filamentosas Thiothrtx.
Por tarto, una alternativa de operación que permite prevenir la proliferación de bacterias filamentosas en sistemas que tratan efluentes anaerobios con elevadas concentraciones de sulfuras, seria disponer de un tanque pulmón que permitiera recular el caudal de tratamiento cuando el sistema anaerobio no fuera capaz de reducir los ACV hasta valores habituales y ajustar la carga modificando el TRH.
Este estudio muestra un episodio de proliferación de bacterias filamentosas y estudia la influencia del TRH sobre el crecimiento de las bacterias filamentosas.
El moribltpo de bacteria filamentosa, identificada en este estudio mediante la técnica FISH, es del tipo Thiothrix, que está asociada a una concentración elevada de sulfuro en el afluente y una alta disponibilidad de materia orgánica en forma de ACV.
El cambio más significativo sobre la mejora del proceso fue el cambio del TRH. Al disminuir el caudal influente se logró disminuir la carga de sulfuro al sistema y la disponibilidad de ACV, siendo estas dos condiciones factores Importantes sobre el crecimiento de las bacterias filamentosas Tfríoífiríí.
los estudios ntlcroblológjcos en estaciones depuradoras basados en las características bacterianas observables al microscopio y las nuevas técnicas moleculares para la identificación permiten identificar correctamente el organismo presente en el sistema y por lo tanto permiten tomar las decisiones adecuadas para controlar o reducir el problema.
Se agradece la financiación del Ministerio de Cienciae innovación {ProyectoCTM20112B5B5-CO2-O1/O2) y de la Universal de Valencia {Proyecto precompetitivo UV-INV-AE11-40639),
1. Amann, R.I., Binder, BJ., Olson, R.J., Chisholm, S.W, Devereux, R., Stanl. D.A. 1990. Combination of 16s Rrna targeted oligonucleotide probes winlh flow cytometry for analyzing mixed microbial populations. Appl Envirom. Microbiology.56 (6). 1919-1925.
2. Borrás, L, 2008. Técnicas microbiológicas aplicadas a la identificación y cuantificación de microorganismos presentes en sistemas EBPR. PhD Thesis. Departamento de Ing. Hidráulica y Medio Ambiente. llPtlitécnlca de Valencia.
3. Darms, H., Bruhl A, Amann K, Sehleifer K.H., Wagnci. M„ 1999. The domain specLfic prabe EUB336 is insufficient for the detection of all Bacteria: Development and evaluation of a more comprehensive probe set. System. Appl. Microbiol. 22. 434-444.
4. Elkclboom, D. H„ 2000. Process control of activated sludge plañís by microscopic Investigation. IWAPublishing, London, UK
5. Giménez J.B., Robles, A, Carretero, L.r Duran, I'., Ruano, M.V, Gattl, M.N., Ribes, J., Ferrer, J. and Seco, A, 20ll. Experimental study of the anaerobic urban wastewater treatment In a submerged hollow-fibre membrane bioreactor at pilot scale. Bioresource Technology. 102. 6799-6606.
6. Jenkins, D„ Richard,M.G., Daigger .G.T., 1993. Manual on the causes and control of activated sludge bulking and foaming. Boca raton,FL: Lewis Publishers.
7. Kanagawa, T, Kamagata. Y., Aruga., S , Kohno, T„ Horn, M„ Wagner M., 2000. Phylogenetic analysis of and oligonucleotide probe development for Eikelboom Type 021N filamentous bacteria Isolated from, bulking activated sludge. Applied and Environmental Microbe Lygy. 6ig II). 5043-5052.
8. Khan, A. A, Gaur, R Z., Tyagl, V. K, Khursheed, A, Lew, Bl, Mehrotra, I., Kazmi, A. A., 2011. Sustainable options of post treatment of UASB effluent treating sewage: a review. Resour. Conserv. Recycl. 55. 1232-1251.
9. Lemmer, H., und G. Lind. 2000. Blähschlamm, Schaum und Schwimmschlamm - Mikrobiologie und Gegenmassnahmen. F. Hirthammer Verlag, München, Germany.
10. Moosbrugger, R.E., Wentzel, M.C., Ekama, G.A., Marais, G.V.R., 1992. Simple Titration Procedures to Determine H2CO3Alkalinity and Short-chain Fatty Acids in Aqueous Solutions Containing Known Concentrations of Ammonium, Phosphateand Sulphide Weak Acid/bases. University of Cape Town,Pretoria, Republic of South Africa. Water Research Commission, Report No. TT 57/92, Research Report W 74.
11. Pujol, R., Vachon, A, Martin ,G., 1990. Technical manual for activated sludge monitoring (guide technique sur le foisonement des boues actives) Document technique, FNDAE N° 8
12. Sanchez-Ramirez J. E., Ruiz-Martinez A., Garcia-usach F., Bouza A., Seco, A., Ferrer,J., 2012. Eliminación de nutrientes del efluente de un reactor anaerobio de membranas sumergidas (SAnMBR) mediante fangos activados y cultivo de microalgas. X reunión de la mesa española de tratamiento de agua.C0-04. 13-16.
13. Unz, RF, Head, IM., 2005. Genus Thiothrix winogradsky 1 888,39a1 in Brenner DJ, Krieg NR, Stanley JT (eds) Bergey, Manual of systematic bacteriology part B. The gammaproteobacteria Vol 2. 2nd edn. Springer science. New York 131-142.
14. Wagner, M., P. Amann, P. Kampfer, B. Assmus, A. Hartmann, P. Hultzler, N. Springer., K. Schleifer., 1994. Identification and in situ detection of Gramnegative filamentous bacteria in activated sludge. System. Appl. Microbiol. 17.405-417.