Resumen
La nefrotoxicidad es un efecto secundario a la lesión renal generada por medicamentos utilizados en el tratamiento del cáncer; esta es una causa de interrupción del tratamiento y disminución de la dosis en quimioterapia debido a la alteración en la tasa de filtración glomerular(TFG). El objetivo fue determinar las alteraciones de la función renal en pacientes adultos con carcinoma de cérvix, testículo, ovario, pulmón, cabeza y cuello que recibían quimioterapia en la unidad de Cancerología del Hospital Universitario Hernando Moncaleano Perdomo.
Es un estudio descriptivo, tipo serie de casos, en el cual se incluyeron 77 pacientes mayores de 18 años con las patologías anteriormente nombradas, atendidos en la unidad de cancerología del Hospital Universitario - Hernando Moncaleano Perdomo de Neiva desde el 1 de marzo de 2001 hasta el 28 de febrero de 2012. Se tuvieron en cuenta pacientes que reportaran medición de creatinina sérica y parcial de orina antes y después de los ciclos de quimioterapia. Se calculó la TFG mediante la ecuación clásica Modification of Diet in Renal Disease MDRD y se usó el algoritmo de Naranjo para observar concordancia entre la reacción adversa a medicamentos (RAM). Las diferencias entre las medidas de antes y después se establecieron mediante el uso de una prueba t student que fue calculada con el software Stata 11,1. Los valores de TFG presentaron una disminución del 9,2%, después de las terapias antineoplásicas. Esta disminución se encuentra en relación con la edad, tipo de neoplasia y el número de ciclos quimioterapéuticos.
Palabras clave: Nefrotoxicidad, quimioterapia, tasa de filtración glomerular, cisplatino.
Abstract
Nephrotoxicity is a side effect to the kidney damage caused by drugs used in the treatment of cancer; this is a cause of treatment interruptionand dose reduction in chemotherapy due to impaired glomerular filtration rate(GFR). This study aimed at determining the changes in renal function in adult patients with carcinoma of the cervix, testis, ovary, lung, head and neckreceiving chemotherapy at the Cancer Unit of University Hospital Moncaleano Hernando Perdomo. It is a descriptive study, case series carried out with77 over-18-year-old patients with the above-mentioned pathologies, treated at the oncology unit at University-Hernando Hospital Moncaleano Perdomo Neiva, from March 1, 2001 to 28 February, 2012. It was taken into account patients reporting measurement of serum creatinine and urine sample before and after chemotherapy cycles. GFR was calculated using the classical equation Modification of Diet in Renal Disease MDRD and Naranjo algorithm was used to observe correlation between adverse drug reactions (ADR).
Differences between measures taken before and after chemotherapy cycles were established by using a student ttest calculate dusing the Stata11.1software. GFR values showed a decrease of 9.2%, after anticancer therapies. This decrease is in relation to age, tumor type and number of chemotherapy cycles.
Key words: Nephrotoxicity, chemotherapy, glomerular filtration rate, cisplatin.
Introducción
Las patologías neoplásicas son manejadas usualmente mediante esquemas de quimioterapia, radioterapia o quirúrgicos. En cuanto al manejo farmacológico, la nefrotoxicidad por el tratamiento antineoplásico, independientemente del tipo de cáncer, es un factor que limita la dosis y/o continuación del mismo. De acuerdo con su mecanismo de acción se clasifican en 3 grupos generales: Fármacos Citotóxicos, Hormonas y otros que atacan dianas específicas. A nivel general, todos los antineoplásicos pueden generar reacciones adversas que se explican por la acción antiproliferativa sobre los tejidos normales, pero existen además reacciones adversas específicas de grupos y fármacos, como las alteraciones nefrourológicas[1].
En cuanto a los efectos nefrotóxicos, el principal grupo sobre el que se han reportado efectos adversos son los derivados del Platino[2][5], y especialmente el Cisplatino. Sus efectos se deben a acumulación del fármaco en las células renales, a estructuras celulares específicos y a inflamación[6]. Por otro lado, los metabolitos del metotrexate (fármaco nefrotóxico poco soluble a pH ácido que se precipita en los túbulos renales, mecanismo que explica la reacción adversa), son eliminados en un 90% por vía renal[7]. La nefrotoxicidad de este medicamento se ve manifestada en forma de injuria renal aguda, alteración en la capacidad de concentración de la orina, deficiencia de eritropoyetina y/o falla renal crónica. De igual manera, se han descrito varios factores de riesgo para la ocurrencia de nefrotoxicidad por antineoplásicos, entre los cuales encontramos las dosis acumulativas y frecuentes del fármaco, toxicidad intrínseca del antineoplásico, edad avanzada y tabaquismo[6][8][9].
Debido a que la quimioterapia a base de fármacos altamente nefrotóxicos es usada ampliamente en nuestro medio, principalmente en el tratamiento de cáncer de cérvix, ovario, testículo, pulmón y de cabeza y cuello, es importante hacer un análisis de la progresión de la Tasa de Filtración Glomerular (TFG) a lo largo del tratamiento quimioterapéutico y determinar la asociación que tienen el uso del tratamiento farmacológico con el efecto nefrotóxico.
Materiales y métodos
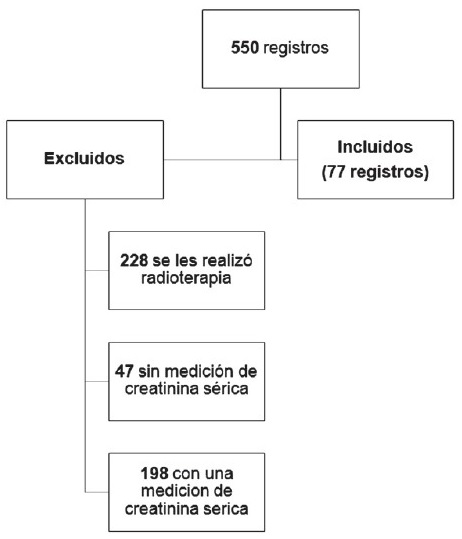
Para el presente trabajo se diseñó un estudio descriptivo, tipo serie de casos. Para el análisis se usaron los registros en la historia clínica de todos los pacientes mayores de 18 años con neoplasias de cérvix, ovario, testículo, pulmón y de cabeza y cuello de la Unidad de Cancerología del Hospital Universitario “Hernando Moncaleano Perdomo” de Neiva en tratamiento quimioterapéutico en el período entre el 1 de marzo de 2001 hasta el 28 de febrero de 2012 y a los cuales se les realizó la medición de Creatinina Sérica y el Parcial de Orina antes y después de los ciclos de quimioterapia. Se revisaron 550 registros que incluyeron las neoplasias mencionadas. Se excluyeron 228 registros debido a que estos pacientes se les realizó manejo adyuvante con radioterapia, 198 por presencia de sólo una medición de Creatinina Sérica, y 47 por ausencia de mediciones de la misma, resultando finalmente 77 registros que cumplían los criterios de inclusión. Solo un caso tuvo reporte del Parcial de Orina, presentándose limitación para conocer la presencia o no de otras alteraciones como hematuria o proteinuria (Gráfica 1).
El valor de la TFG se determinó mediante la fórmula Modification of Diet in Renal Disease(MDRD):
Los valores normales de la TFG son de 90 a 120 mL/min/1.72 m2 y un descenso rápido y marcado de esta durante el tratamiento es predictivo de nefrotoxicidad. Se considera nefrotoxicidad con un rango de 60 ml/min/m2 o menos con la fórmula MDRD
Se comparó la TFG de pacientes con antecedentes que pudieran causar alteración de la funcionalidad renal, como Hipertensión Arterial (HTA), Diabetes Mellitus, Tabaquismo o Infecciones de vías urinarias con aquellos que no presentaban antecedentes de este tipo. Igualmente se tuvieron en cuenta variables como edad, género, tipo de neoplasia, medicamento utilizado y número de ciclos de quimioterapia. Los promedios de las mediciones de creatinina sérica mediante la fórmula de MDRD antes y después fueron comparados de acuerdo a la caracterización realizada con las variables anteriormente mencionadas y mediante el uso de una prueba t - Student para variables continuas se verificó la significancia de los cambios ocurridos entre los dos períodos observados (p <0,05). Para determinar la causalidad del efecto adverso debido al agente quimioterapéutico se empleó el Algoritmo de Naranjo, propuesto por la Organización Mundial de la Salud (OMS) y ampliamente usado en la práctica clínica[10][14]. El análisis estadístico se realizó por medio del software STATA, versión 11.1 (StataCorp) módulo estadísticas, opción pruebas de hipótesis (mean-comparison test, paired data.).
El estudio fue aprobado por el comité de ética del Hospital Universitario Hernando Moncaleano Perdomo de la ciudad de Neiva por clasificarse en la categoría de investigación con riesgo mínimo según el artículo 11 contemplado en la resolución 8430 de 1993 del Ministerio de Salud y sigue las normas según la declaración de Helsinki de 1964 adaptada a su enmienda de 2004.
|
Resultados El esquema del proceso de inclusión y exclusión se esquematiza como sigue (Figura1). |
X
|
|
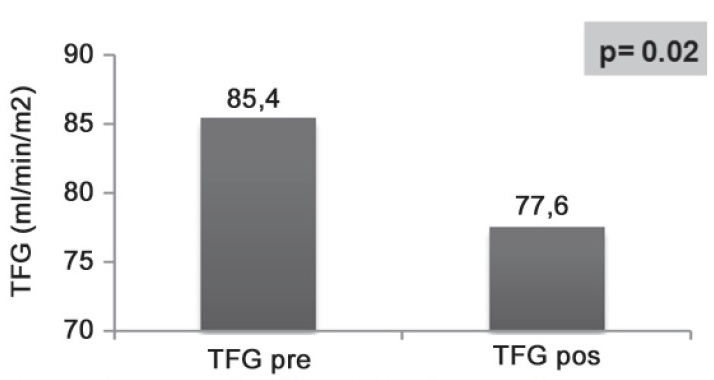
De los 77 pacientes, 16 (20,7%) eran del género masculino, y 61 (79,3%) del género femenino. La edad mínima del total de pacientes fue 23 años y la máxima 78 años, con un promedio de 52,7 años. La edad mínima de los pacientes masculinos fue 32 años y la máxima 78 años, con un promedio de 56 años de edad, mientras que en las pacientes femeninas la edad mínima fue de 23 años y la máxima 75 años, con un promedio de 51,8 años. Se analizó la frecuencia de cada tipo de neoplasia dentro de la muestra. El tipo de neoplasia más frecuente fue el de cérvix (62,3%), seguido de cabeza y cuello (11,7%), pulmón (10,4%), ovario (10,4%) y testículo (5,2%). La TFG pre y TFG post tratamiento para evaluar la función renal a nivel general de todos los pacientes incluidos. La diferencia en el promedio de los valores de TFG pre tratamiento y post tratamiento fue del 9,2%, la cual fue estadísticamente significativa (prueba t, p = 0,02). Este hallazgo sugiere que el tratamiento quimioterapéutico tiene un efecto negativo sobre la tasa de filtración glomerular en los pacientes sometidos a éste. (Figura 2). |
X
|
|
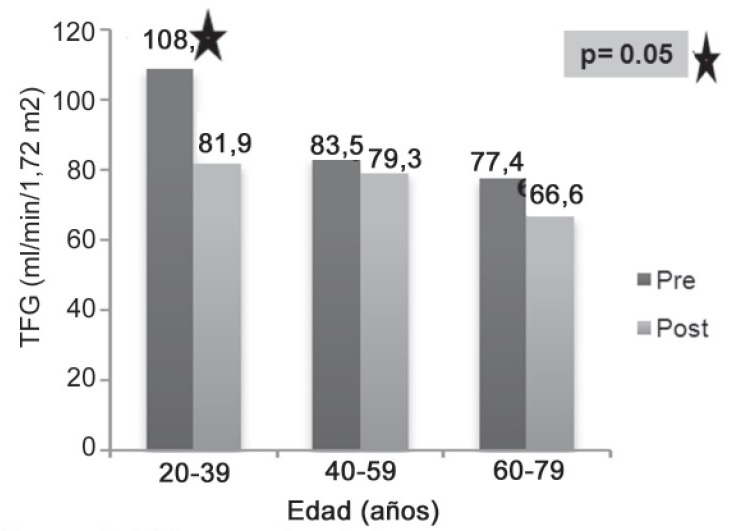
Los valores de MDRD antes y después del tratamiento en relación a la edad mostró que sólo el grupo de pacientes entre 20 y 39 años presento un descenso estadísticamente significativo (Prueba t, p = 0.05) en la TFG posterior a los ciclos de quimioterapia (Figura 3). |
X
|
|
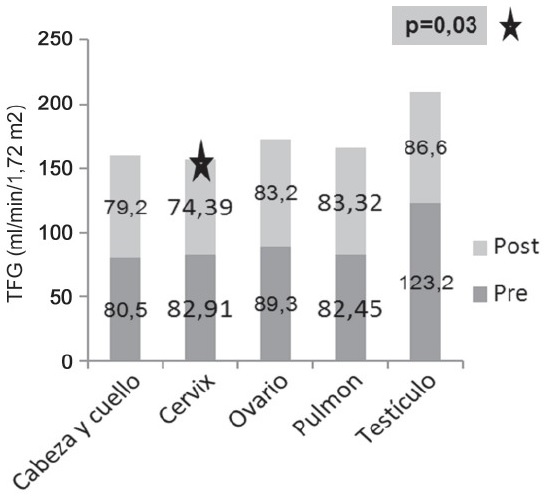
Respecto a los niveles de MDRD antes y después del tratamiento en relación el género de los pacientes en estudio se evidenció un descenso en los valores de la TFG y en mayor proporción en pacientes masculinos con una diferencia de 11,5 ml/min/1.72m2; sin embargo en el análisis no se encuentran diferencias estadísticamente significativas en relación con el género. En la filtración glomerular antes y después del tratamiento de acuerdo al tipo de neoplasia de los pacientes estudiados se evidencio, una disminución general de la TFG luego de la aplicación de agentes antineoplásicos que descriptivamente se hace más evidente en el grupo de patologías testiculares y de ovario pero que no resultan ser estadísticamente significativas. Por su parte la disminución en las medidas del MDRD en las pacientes con Ca de cérvix aunque no se observan tan marcadas en el análisis descriptivo, resultaron ser estadísticamente significativas (p= 0,03) en esta hay una disminución de 5,4 ml/min/m2 en la TFG que corresponde al 6,64%. Para los casos de enfermedades de cabeza y cuello y pulmón, los efectos parecen ser menores para el grupo de pacientes analizados. En el caso de Cabeza y cuello la reducción es de 1.3 ml/min/m2 la filtración glomerular equivalentes a 1.6%. En el caso de Ca de pulmón, contradictoriamente hubo un aumento de la misma de 2 ml/min/1.72m2. Estos cambios y las asociaciones significativas evidenciadas podrían estar relacionados con la dosis utilizada para el tratamiento de cada entidad, ya que es evidente que para algunas neoplasias es necesario el uso de mayor cantidad de fármaco. (Figura 4) |
X
|
|
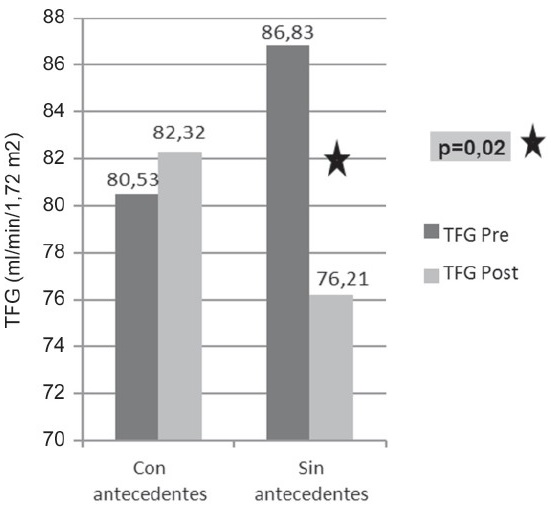
El comportamiento de la filtración glomerular antes y después del tratamiento de acuerdo a los antecedentes presentados en el grupo de pacientes estudiados nos muestra un descenso significativo (prueba t, p= 0,02) en la TFG de los pacientes sin antecedentes o factores de riesgo de nefrotoxicidad. De igual manera, a pesar de que se supone un mayor descenso en la TFG en los pacientes con antecedentes, se observó un aumento en los valores de esta. (Figura 5). |
X
|
|
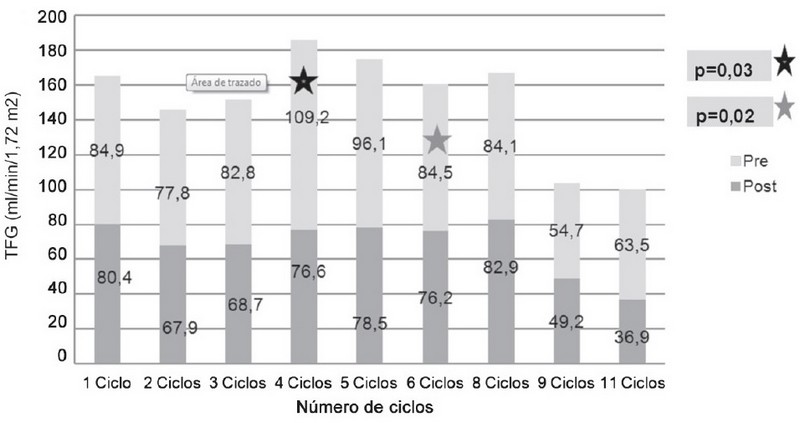
La TFG según el número de ciclos de quimioterapia realizados en los pacientes mostró una disminución en los valores de filtración glomerular posterior al tratamiento quimioterapéutico independientemente del número de ciclos. La distribución muestra que hubo un mayor descenso a medida que aumentaron el número de ciclos; dicha disminución resultó estadísticamente significativa en el grupo de pacientes con 4 y 6 ciclos. (Figura 6). |
X
|
|
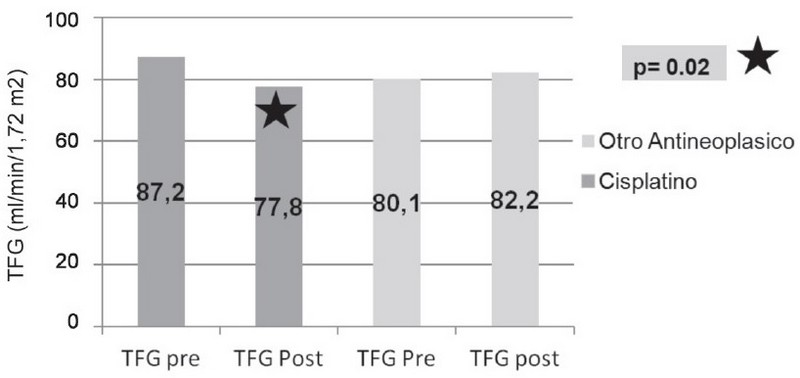
La TFG pre y post en pacientes que recibieron tratamiento a base de cisplatino en comparación a los pacientes que recibieron tratamiento con otro medicamento antineoplásico mostró una reducción en su TFG posterior al tratamiento de 9.46 ml/min/1.72m2 que resultó estadísticamente significativa (prueba t, p= 0,02). En los pacientes que recibieron tratamiento con otro antineoplásico se presentó un aumento en su TFG posterior al tratamiento de 2,11 ml/min/1,72m2 sin diferencias estadísticamente significativas Debido a que el cisplatino fue el principal fármaco usado en los esquemas de quimioterapia en nuestro grupo de estudio, y a que el análisis de comparación de promedios identificó un cambio significativo, se realizó un análisis de causalidad respecto del uso de cisplatino y el efecto adverso presentado en los pacientes respecto a su TFG. (Figura 7). |
X
|
Se calculó mediante el Algoritmo de Naranjo la probabilidad de que la nefrotoxicidad hubiera sido causada por la administración de este agente. Respondiendo a cada una de las preguntas en la lista del algoritmo mediante el cual se calcula la probabilidad de reacción adversa a un fármaco, se encontró que en el 3% de los casos había una probabilidad segura, en el 21% hubo una causalidad probable, el 57% fue posible y el 19% fue improbable.
Discusión
Nuestro estudio evidencia la disminución de la TFG en un grupo de pacientes con diversos tipos de neoplasias cuyo manejo fue a través de quimioterapia.
Dentro de los principales hallazgos se encuentra una disminución del 9,2% en los valores de la TFG posterior a la quimioterapia, que resulta ser estadísticamente significativa, efecto que concuerda con lo descrito en la literatura[2][6][8][15]. De acuerdo con los grupos etarios, sólo el grupo de pacientes entre 20 y 39 años tuvo un descenso estadísticamente significativo de la TFG posterior a los ciclos de quimioterapia comparado con los grupos entre 40 y 59 años y 60 y 79 años, opuesto a lo encontrado por Launay-Vacher y cols, donde la mayor disminución de la TFG se presentó en pacientes mayores de 75 años[16].
La evolución de la TFG según el género, mostró una disminución posterior al tratamiento quimioterapéutico, que no fue estadísticamente significativa. Sin embargo, se ha observado en investigaciones como la de Launay-Vacher y cols que una mayor proporción de hombres presentan TFG por debajo de 30 ml/min/1,72 m2, mientras una mayor proporción de mujeres presentan TFG entre 60 y 89 al final de los tratamientos[16].
Existen publicaciones donde se reporta disminución de la TFG en carcinomas de seno, testículo, ovario, colorrectal, pulmón, próstata y cérvix[15][17]. En el presente estudio, se identificó una disminución significativa en el grupo de pacientes con neoplasias de cérvix, lo anterior debido a que fue el cáncer con mayor frecuencia en nuestra población de estudio (62,3%). En el grupo de pacientes con neoplasia de testículo, se evidenció un fuerte descenso en los valores de la TFG, sin embargo esta no resulto significativa; la drástica disminución de este parámetro (70,2%) puede ser atribuida al mayor número de ciclos de quimioterapia que incluye el esquema de tratamiento en este tipo de neoplasia.
Contrario a lo que se esperaba, hubo una disminución significativa en la TFG en el grupo de pacientes que no presentaban antecedentes o factores de riesgo para nefrotoxicidad por los agentes quimioterapéuticos. Diversos estudios han descrito los factores que pueden incrementar el riesgo de nefrotoxicidad por quimioterapia[6][8][9]; sin embargo, el presente análisis solo encontró que el 20% de los pacientes incluidos reportaran un factor de riesgo, razón por la cual el tamaño de muestra no resultó suficiente para comprobar esta hipótesis.
También ha sido documentado que un mayor número de ciclos y dosis acumulativas de los fármacos usados en quimioterapia contribuye a un mayor efecto nefrotóxico en el descenso de los valores de TFG posterior al tratamiento, lo cual resultó estadísticamente significativo en los grupos con 4 y 6 ciclos de quimioterapia[6][9].
Mediante el Algoritmo de Naranjo se calculó la probabilidad de que el efecto nefrotóxico hubiera sido causado por la administración de cisplatino. Sólo el 3% de los registros tuvo una probabilidad segura, mientras que en el 57% se encontró una causalidad posible. En conclusión mediante este análisis se pudo corroborar que la aparición de nefrotoxicidad podría no estar asociada al manejo quimioterapéutico con éste fármaco específico, y en consecuencia podría deducirse que existen muchos factores externos a la administración del mismo que influyen en la ocurrencia del efecto adverso. A la fecha no se cuenta con estudios que confirmen la causalidad de la disminución de la TFG por los agentes quimioterapéuticos, y por lo tanto resulta necesario desarrollar más investigación al respecto así como una mayor vigilancia farmacológica que permita contar con datos confiables para la realización de análisis sobre este evento adverso, ya que la falta de información acerca de la farmacovigilancia fue un factor limitante para el presente análisis.
Agradecimientos
Los autores expresan su gratitud a la Unidad de Cancerología del Hospital Universitario Hernando Moncaleano Perdomo por haber apoyado el desarrollo del presente estudio y haber facilitado los registros e historias clínicas que permitieron los análisis.
También agradecemos a la Doctora Paola Mosquera por sus recomendaciones para la realización de los análisis epidemiológicos en el programa STATA y al Doctor Rodrigo Benavidez López por su revisión y recomendaciones al artículo.
Referencias
1. Goodman and Gilman’s, The Pharmacological Basis of Therapeutics, 12th Edition The McGraw-Hill Companies, Inc. pp: 60-63.
2. Escobar Torres, Carlos Alberto. Identificación de los efectos tóxicos producidos por los fármacos antineoplásicos utilizados en el Centro Radioncológico del Caribe en la Ciudad de Cartagena, durante el año 2010. Maestría tesis, Universidad Nacional de Colombia. 2011.
3. Haschke M, Vitins T, Lude S, et. al. Urinary excretion of carnitine as a marker of proximal tubular damage associated with platin-based antineoplastic drugs: Nephrol Dial. 2010;25(2):426-33.
4. Uehara T, Yamate J, Torii M, et. al. Comparative Nephrotoxicity of Cisplatin and Nedaplatin: Mechanisms and Histopathological Characteristics. J Toxicol Pathol. 2011;24(2):87-94.
5. Fujieda M, Matsunaga A, Hayashi A, et. al. Children’s toxicology from bench to bed-Drug-induced Renal Injury: Nephrotoxicity induced by Cisplatin and Ifosfamide in Children.. Sci. Vol 34, Suppl 2, Issue: Ii. 2009. Pages:SP251-P257.
6. Miller R P, Tadagavadi R K, Ramesh G et. al. Mechanisms of Cisplatin Nephrotoxicity. Toxins. 2010;2490-2518; doi: 10.3390
7. Widemann BC, Adamson PC. Understanding and Managing Methotrexate Nephrotoxicity. The Oncologist.2006;11:694-703.
8. Perazella MA, Moeckel GW. Nephrotoxicity from chemotherapeutic agents: clinical manifestations, pathobiology, and prevention/therapy. Semin Nephrol. 2010;30(6):570-581.
9. Ferreiro J, García J.L., Barceló R et. al. Quimioterapia: efectos secundarios. Gac Med Bilbao. 2003;100:69-74.
10. Farcas A, Bojita M. Adverse Drug Reactions in Clinical Practice: a Causality Assessment of a Case of Drug-Induced Pancreatitis, Gastrointestin Liver Dis. 2009;18(3):353-358.
11. Busto U, Naranjo CA, Sellers EM. A method for estimating the probability of adverse drug reactions, Br J Clin Pharmacol. 1982;13(2):223-227.
12. Son YM, Lee JR, Roh JY. Causality assessment of cutaneous adverse drug reactions. Ann Dermatol. 2011;23(4):432-438.
13. Padhy BM, Shanmugam SP, Gupta YK, Goyal A. Reversibleposterior leucoencephalopathy syndrome in an elderly male on sunitinib therapy. Br J ClinPharmacol. 2011;71(5):777-779.
14. The use of the WHO–UMC system for standardized case causality assessment. Accessed at http://www.who-umc.org/graphics/4409.pdf [Link] on February, 28th, 2009.
15. Hartmann JT, Kollmannsberger C, et al. Platinum Organ Toxicity and Possible Prevention in Patients with Testicular Cancer. Int. J Cancer. 1999;83, 866-869.
16. Launay-Vacher V, Oudard S, et al. Prevalence of Renal Insufficiency in Cancer Patients and Implications for Anticancer Drug Management. Cancer 2007;110: 1376-84.
17. Dash A, Galsky MD, et. al. Impact of Renal Impairment on Eligibility for Adjuvant Cisplatin-Based Chemotherapy in Patients With Urothelial Carcinoma of the Bladder. Cancer. 2006;107:506-513.
