Resumen
El Toxoplasma gondii es un patógeno oportunista frecuente en pacientes con Síndrome de Inmunodeficiencia Adquirida (Sida) aunque su enfermedad es rara en áreas geográficas con fácil acceso a la terapia antirretroviral altamente efectiva (HAART). La presentación clínica usual compromete el sistema nervioso central, retina y tracto respiratorio. La toxoplasmosis con diseminación a médula ósea es infrecuente en pacientes con sida como se puede evidenciar en los pocos casos reportados en la literatura, la mayoría de los cuales ocurren en pacientes después de trasplante de médula ósea. Describimos el caso de una paciente con diagnóstico previo de infección por VIH e interrupción de la terapia antirretroviral que desarrolló fiebre y pancitopenia severa y a quien se le documentó tuberculosis pulmonar y presencia de taquizoítos de toxoplasma en aspirado de médula ósea. La toxoplasmosis diseminada a médula ósea debe ser considerada un diagnóstico diferencial en pacientes con VIH, fiebre y compromiso hematológico.
Palabras clave: Toxoplasmosis diseminada, VIH, sida, médula ósea, toxoplasma gondii.
Abstract
Toxoplasma gondii is a common opportunist pathogen in patients with Acquired Immunodeficiency Syndrome (AIDS) although its presentation is rare in geographic areas with easy access to highly effective antiretroviral therapy (HAART). The usual clinical presentation involves the central nervous system, retina and respiratory tract. Toxoplasmosis with dissemination to bone marrow is uncommon in AIDS patients as evidenced in the few cases reported in the literature, most of them take place in patients after bone marrow transplant. Here it is described the case of a patient with a previous diagnosis of HIV infection and interruption of HAART who had fever and severe pancytopenia and who has documented pulmonary tuberculosis and toxoplasma tachyzoites presence in bone marrow aspirate. Toxoplasmosis disseminated to bone marrow should be considered as a differential diagnosis in patients with HIV, fever and hematologic involvement.
Keywords: Disseminated toxoplasmosis, HIV, AIDS, bone marrow, toxoplasma gondii.
Introducción
La toxoplasmosis es una infección oportunista reconocida en pacientes infectados por el Virus de Inmunodeficiencia Humana (VIH), causada usualmente por la reactivación de una infección previa.toxoplasma gondii provoca una infección asintomática o un cuadro febril con linfadenopatías en pacientes inmunocompetentes. En pacientes con VIH puede llegar a causar un cuadro clínico que compromete la vida con afectación principal del sistema nervioso central; la infección diseminada con compromiso multiorgánico no es inusual en otros contextos de inmunosupresión y puede llegar a tener una mortalidad de 100% sin tratamiento. El compromiso multiorgánico del parásito ha sido documentado en hallazgos de necropsias de pacientes con trasplante de órganosy los sitios más comúnmente afectados incluyen ojos, hígado, páncreas, adrenales y riñones. La extensión del microorganismo a médula ósea es extraordinariamente rara, especialmente en pacientes con VIH.
Presentamos un caso interesante de toxoplasmosis diseminada, en una paciente con VIH quien interrumpió la terapia antirretroviral y cursó con fiebre prolongada, pancitopenia y evidencia de taquizoítos de toxoplasma en médula ósea. Este caso ilustra la necesidad de tener una alta sospecha de toxoplasmosis diseminada en este tipo de pacientes con alteración hematológica y fiebre de origen desconocido.
Reporte de caso
Paciente femenina de 26 años de edad con historia de 6 años de diagnóstico de infección por VIH quien se encontraba en tratamiento antirretroviral de manera irregular con Didanosina, Abacavir y Efavirenz, los cuales había suspendido en los últimos 6 meses de manera voluntaria. Consulta a nuestro hospital por cuadro clínico de 1 mes de evolución de pérdida de peso, astenia, adinamia asociado a fiebre, diaforesis de predominio nocturno, tos con expectoración hemoptoica y disnea de moderados esfuerzos.
|
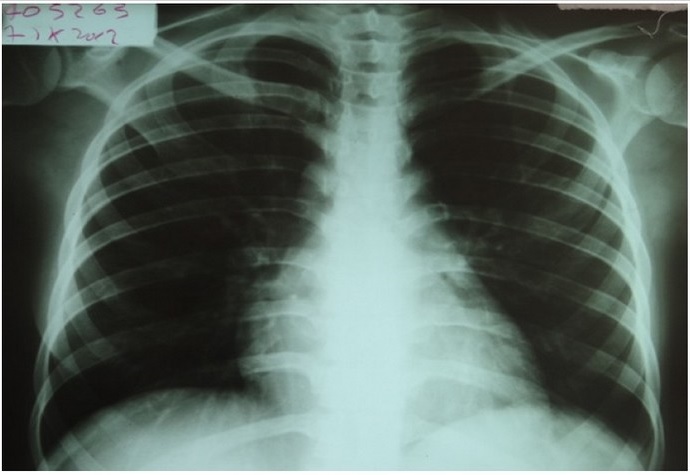
Al examen físico de ingreso se encontró una paciente emaciada, peso 56 kilos. Signos vitales: Presión arterial: 100/60 mmHg, Frecuencia cardiaca: 89 x minuto, Frecuencia respiratoria: 23 x minuto, Temperatura: 38°C. Al examen físico por sistemas presencia de estigmas de sangrado gingival, a la auscultación pulmonar sibilancias espiratorias. No se encontraron adenopatías ni lesiones cutáneas. Paraclínicos iniciales: Hemograma con pancitopenia; Leucocitos: 2000/mm3, Polimorfonucleares: 79%, Linfocitos 8,4%, hemoglobina: 8,4g/dl, VCM: 82fL, HCM: 25,4pG, plaquetas: 58.000/mm3. Frotis de sangre periférica: glóbulos rojos con hipocromía, anisocitosis y microcitosis; glóbulos blancos disminuidos en número con morfología normal; Plaquetas disminuidas en número con morfología normal. Gasimetría arterial sin trastornos en la oxigenación. Por hallazgos respiratorios y radiológicos en tórax con opacidades intersticiales reticulonodulares (Fig. 1) en el contexto de una paciente inmunocomprometida, se inicia empíricamente ampicilina/sulbactam considerando posible neumonía adquirida en la comunidad de etiología bacteriana y Trimetoprim/sulfametoxazol (TMP/SMX) para tratamiento de gérmenes oportunistas, especialmente Pneumveystisjirvveeii. |
X
|
|
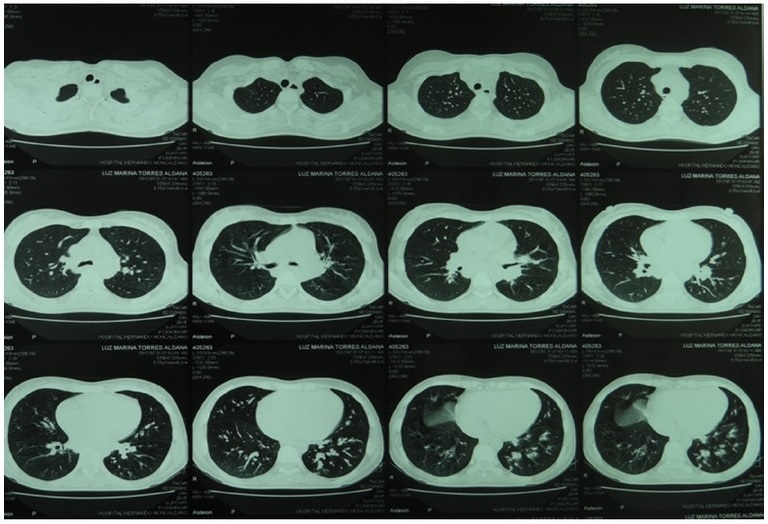
Dentro de los estudios imaginológicos iniciales se realizó To-mografía de Tórax de Alta Resolución (TACAR) que evidenció lesiones nodulares múltiples de predominio en lóbulo inferior izquierdo y consolidación posterobasal de distribución atelectásica con presencia de adenopatías parahiliares (Fig. 2). Se realizó fibrobroncoscopia con hallazgos normales en epiglotis, cuerdas vocales, tráquea, carina y bronquios fuente. Se realizó lavado broncoalveolar y biopsia del segmento posterior de lóbulo inferior izquierdo. Se solicitó estudio mi-crobiológico y evaluación del compromiso por la infección viral con recuento de células T CD4, T CD8 y carga viral para VIH. |
X
|
Se consideró paciente con sida con alta sospecha de infección pulmonar oportunista y pancitopenia por lo que se adicionó cubrimiento antimicrobiano empírico para histoplasmosis con Anfotericina B y tuberculosis con Rifampicina, Isoniazida, Pirazinamida y Etambutol. Se cambió TMP/SMX a esquema alterno de tratamiento de pneumocistosis con Clindamicina más Primaquina por la pobre recuperación hematológica y posible toxicidad medular medicamentosa agregada.
La carga viral para VIH fue de 1.581.648 copias/ml (log10 6); el recuento de linfocitos T CD4 fue 13,23 células/mm3 (5,17%), con una relación CD4/CD8 de 0,10.
La paciente persistió con fiebre y cursó con mayor deterioro hematológico con requerimiento de soporte transfusional de glóbulos rojos empaquetados y plaquetas, con aparición de grandes lesiones ulceradas dolorosas en la boca por lo que se agregó Ganciclovir intravenoso a la terapia por sospecha de enfermedad diseminada por citomegalovirus (CMV), debido a recuento de células T CD4<50/ mm3 que podía explicar no solo las lesiones orales sino también el compromiso medular y la evolución tórpida de la paciente. Se realizó Reacción en Cadena de la Polimerasa en sangre para CMV cuyo resultado fue negativo, sin embargo recibió 14 días de terapia antiviral. Se realizó aspirado de médula ósea más biopsia.
Las coloraciones especiales del lavado broncoalveolar obtenidas de la fibrobroncoscopia fueron negativas para estructuras micóticas, la baciloscopia fue positiva para Bacilos Acido Alcohol Resistentes, configurando el diagnóstico de tuberculosis pulmonar. El reporte de antigenuria e inmunodifusión en sangre fueron negativos para Histoplasma, por lo que se suspendió la terapia con Anfotericina B después de 8 días.
|
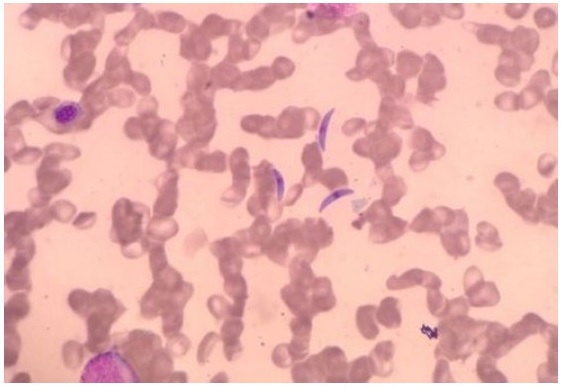
El aspirado y biopsia de médula ósea fue llevado a cabo como parte del estudio de la pancitopenia, que para ese momento había empeorado, en busca de infección oportunista diseminada Vs toxicidad medicamentosa y para descartar la presencia de enfermedad neoplásica. Con la coloración de Wright se observó la presencia de escasas estructuras parasitarias en forma de media luna, de bordes puntiagudos y núcleo central compatibles con toxoplasma (Fig. 3). Ante estos hallazgos se reanudó la terapia para toxoplasmosis con sulfas, se continuó la quimioterapia antituberculosa, se inició terapia antirretroviral con Tenofovir/Emtricitabina+ Inhibidor de proteasa reforzado y se empleó Factor Estimulante de Colonias de Granulocitos G-CSF (Filgastrim) 300|ig subcutáneos al día como medida adicional para contrarrestar el posible efecto hematológico deletéreo de las medicaciones utilizadas, con mejoría de la pancitopenia. La paciente presentó evolución clínica satisfactoria con resolución de la fiebre y recuperación medular. |
X
|
Discusión
T. gondii produce una de las infecciones por protozoarios más conocidas y de mayor distribución mundial[1]. Los gatos son la única fuente reconocida como huésped definitivo del parásito, pero los humanos pueden ser infectados por la ingestión de ooquistes o quistes tisulares[2]. En individuos inmunocompetentes la infección inicial y la siembra en diferentes órganos conllevan a una infección crónica o latente sin relevancia clínica. El estado crónico de la infección corresponde a la persistencia asintomática de los quistes tisulares en múltiples tejidos. Periódicamente, los bradizoítos son liberados de los quistes tisulares por medio de su ruptura, que conlleva a un proceso clínicamente silente contenido efectivamente por el sistema inmunológico y que a nivel del sistema nervioso central (SNC) resulta en pequeños núcleos inflamatorios, con un grado limitado de muerte y daño en la arquitectura neuronal[3].
El parásito infecta a un tercio de la población mundial[4]; la infección primaria es usualmente silente, pero la linfadenopatía cervical o enfermedad ocular puede presentarse en individuos inmunocompetentes[5]. La reactivación de la infección es usualmente suprimida por la inmunidad celular. La enfermedad severa por T. gondii y la muerte son más frecuentes en pacientes con severo compromiso de la inmunidad celular, como sucede en pacientes con infección por VIH o en trasplantados de médula ósea y órganos sólidos[6][7].
La reactivación de la infección y subsecuente cuadro patológico es usualmente confinada a un simple órgano o sistema. La enfermedad diseminada es bastante rara pero usualmente fatal en ausencia de tratamiento específico[5].
La toxoplasmosis cerebral es una seria complicación en las personas infectadas por VIH, sin embargo los pacientes pueden desarrollar una amplia variedad de complicaciones. El diagnóstico se basa en la presencia de hallazgos clínicos y radiológicos compatibles y de la misma forma se evalúa su evolución.
En países tropicales, la frecuencia de encefalitis por toxoplasma en series de necropsias de pacientes con sida es alta; 34% en Brasil, 19% en la India[8]. El riesgo de desarrollar Toxoplasmosis cerebral está entre 30 y 40% en los pacientes con VIH que poseen anticuerpos Ig G para Toxoplasma con bajos recuentos de linfocitos T CD4. La incidencia de la enfermedad es baja en pacientes seronegativos para T. gondii[4]. El porcentaje de pacientes con VIH y anticuerpos antiToxoplasmavaría según la zona geográfica a nivel mundial y en Colombia es superior al 60%[9][10]
Inmunidad celular en paciente VIH positivos
Los linfocitos T CD4+ son cruciales para la protección durante la infección por toxoplasma, como queda demostrado con la emergencia de toxoplasmosis severa tras el descenso concomitante en las células T en pacientes infectados por VIH[6]. Durante etapas iniciales de la infección, estas contribuyen a la respuesta óptima de las células B y T CD8+ y la habilidad de dichas células para controlar la infección crónica atribuidas a la producción de citoquinas como el Interferón y (IFN-y) o a la expresión de CD40L, el cual a su vez puede activar mecanismos efectores en macrófagos y otras células de la inmunidad innata que expresan CD40 en su superficie[6][11].
La introducción de la terapia antirretroviral altamente efectiva ha disminuido significativamente la mortalidad en pacientes con sida en países desarrollados desde su introducción en 1996[12]. Similares resultados se han obtenido en países en desarrollo con acceso libre y universal a la terapia antirretroviral[13]. Importante también ha sido el amplio uso de regímenes de profilaxis activos contra T. gondii[14] con recuentos de linfocitos T CD4+ inferiores a 100 células/mm3.
La presentación clínica de la infección por toxoplasma es rara en pacientes con conteos de linfocitos T CD4 > 200 células/ mm3; en contraste, existe un mayor riesgo con CD4+ < 50 cel/ mm3[10]. El examen físico puede demostrar compromiso neurológico; la progresión de la enfermedad resulta en convulsiones, estupor y coma. El compromiso multiorgánico aunque raro, puede observarse después de la diseminación de la infección y llegar a ser fatal[15][16].
En individuos con deficiencia de la inmunidad celular como el descrito, una proliferación rápida y no controlada por parte del parásito puede llegar a afectar cualquier órgano: cerebro, ojos, corazón, pulmón, tracto gastrointestinal, músculo, etc. La diseminación hematógena se ha comprobado por el desarrollo simultáneo de lesiones en cerebro y presencia de parasitemia en algunos pacientes con sida y encefalitis por toxoplasma[3][17].
Un estudio que evaluó la presencia de toxoplasmosis en pacientes con VIH en el seguimiento de una cohorte de 7 años, encontró compromiso cerebral en 89% de los casos, pulmonar 6%, ocular 3,5% y diseminada en 1,7% en hospitales de Estados Unidos 18. El estudio nacional francés de toxoplasmosis extra-cerebral se adelantó durante los años 1990-1992 y recolectó datos de 199 pacientes VIH positivos; la prevalencia de compromiso por fuera del SNC se estimó en 1,5-2%; y de éstos la recuperación del parásito en sangre y médula ósea fue de 3%[19].
Los datos serológicos son de escasa utilidad en cuanto a la confirmación del diagnóstico. El examen ocular con fondo de ojo, el lavado broncoalveolar, la búsqueda del parasito en sangre, los estudios radiológicos, moleculares con Reacción en Cadena de Polimerasa y la biopsia de tejidos potencialmente comprometidos, son las principales herramientas diagnósticas[20][21].
La toxoplasmosis extra-cerebral y por ende la diseminación con compromiso de la médula ósea es generalmente difícil de diagnosticar por la presencia de síntomas y signos clínicos inespecíficos como en el caso de nuestra paciente[4][22]. Por lo tanto generalmente el diagnóstico se realiza post-mortem y su prevalencia es frecuentemente subestimada.
La paciente del caso clínico recibió desde el inicio manejo empírico para infecciones oportunistas frecuentes en su contexto y según los datos epidemiológicos locales. Después, la terapia fue extendida considerando la evolución clínica y ajustada por la potencial toxicidad medular de la medicación, pero retomada y dirigida gracias a la documentación de la etiología infecciosa. La evolución posterior de la paciente fue favorable, se instauró una terapia específica contra los dos agentes oportunistas que fueron identificados de muestras biológicas de lavado broncoalveolar y médula ósea: tuberculosis y toxoplasmosis, respectivamente y luego dentro de las primeras 2 semanas se dio inicio a la terapia antirretroviral, con mejoría clínica que permitió su egreso hospitalario.
Conclusiones
Este caso ilustra la necesidad de sospechar la presencia de toxoplasmosis diseminada con infiltración medular en pacientes con VIH y recuento de células T CD4<50/mm3 que cursan con un cuadro febrilprolongado y pancitopenia. El compromiso hematológico debe hacer considerar diversas posibilidades diagnósticas en pacientes severamente inmunocomprometidos (sepsis, toxicidad farmacológica, enfermedades neoplásicas, infecciones invasoras) lo que obliga a realizar el estudio histopato-lógico de médula ósea.
Conflictos de intereses
Los autores de este trabajo declaran que no presentan conflicto de interés.
Financiación
Los autores declaran no tener fuente financiera para el artículo.
Referencias
1. Dubey JPThe history of Toxoplasma gondii-the first 100 years. Journal of Eukaryotic Microbiologyl. 2008;55(6):467-475. http://dx.doi.org/10.1111/¡.1550-7408.2008.00345.x[Link]
2. Kasper L, Courret N, Darche S, et al. Toxoplasma gondii and mucosal Immunity. International Journal for Parasitology 2004;34(3):401 -409. http://dx.doi.org/10.1016/j.ijpara.2003.11.023[Link]
3. Montoya J, Boothroyd J. Toxoplasma gondii In: Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases. Vol. 2, 7th ed. Churchill Livingstone: An Imprint of Elsevier; 2010. Chapter 279: p. 34953526.
4. Sharenda L, Burton E. Disseminated toxoplasmosis in a patient with undiagnosed AIDS. Baylor University Medical Center Proceedings 2009;22(1):20-22.
5. Herold MA, Kühne R, Vosberg M, Ostheeren S, Vogt P; Karrer U. Disseminated toxoplasmosis in a patient with non-Hodgkin lymphoma. Infection. 2009;37:551-554.http://dx.doi.org/10.1007/s15010-009-9007-5 [Link]
6. Dupont, CD. Christian DA, Hunter CA. Immune response and immunopathology during toxoplasmosis. Seminars in Immunopathologyl. 2012;34(6):793-813. http://dx.doi.org/10.1007/s00281-012-0339-3 [Link]
7. Lappalainen M, Jokiranta S, Halme L, et al. Disseminated toxoplasmosis after liver transplantation: Case report and review. Clinical Infectious Diseases. 1998;27:1327-8. http://dx.doi.org/10.1136/jcp.55.8.637 [Link]
8. Cabre P Smadja D, Cabie A, Newton CR. HTLV-1 and HIV infections of the Central Nervous system in tropical areas. Jornual Neurology Neurosurgery Psychiatry. 2000;68:550-557. http://dx.doi.org/10.1136/jnnp.68.5.550 [Link]
9. Gómez JE, Gómez JE, Alvarado F, Hernández C, Cuervo S, Saravia J. Tratamiento de la fase aguda de la toxoplasmosis cerebral con Clindamicina - Falcidar (pirimetamina-sulfadoxina) en pacientes infectados por VIH. Infection. 2001;5(3):163-169.
10. Abgrall S, Rabaud C, Costagliola D. Incidence and risk factors for toxoplasmic encephalitis in human immunodeficiency virus-infected patients before and during the highly active antiretroviral therapy era. Clinical Infectious Diseases. 2001;33:1747-55.
11. Machala L, Maly M, Hrdá S, Rozsypal H, Stañková M, Kodym P. Antibody response of HIV-infected patients to latent, cerebral and recently acquired toxoplasmosis. European Journal of Clinical Microbiology & Infectious Diseases. 2009;28:1 79-1 82. http://dx.doi.org/10.1007/s10096-008-0600-9[Link]
12. Palella FJ, Delaney KM, Moorman AC, et al. Declining morbidity and mortality among patients with advanced human immunodeficiency virus infection. HIV Outpatient Study Investigators. The New England Journal of Medicine. 1998;338:853-860. http://dx.doi.org/10.1056/NEJM199803263381301 [Link]
13. Varughese JK, Rosenberg MG, kim K. HIV in the tropics: staging in the resource-limited setting. Current Opinion in Infectious Diseases. 2012;25:477-483. http://dx.doi.org/10.1097/QC0.0b013e3283567b00[Link]
14. Leport C, Chene T, Morlat P, et al. Pyrimethamine for primary prophylaxis of toxoplasmic encephalitis in patients with human immunodeficiency virus infection: a double-blind, randomized trial. The Journal of Infectious Diseases. 1996;173:91-7.
15. Signorini L, Gulletta M, Coppini D, et al. Fatal disseminated toxoplasmosis during primary HIV infection. Current HIV Research. 2007;5:273-274. http://dx.doi.org/10.2174/157016207780077011 [Link]
16. Eza DE, Lucas SB. Fulminant toxoplasmosis causing fatal pneumonitis and myocarditis. HIV Medicine. 2006; 7:415-420. http://dx.doi.org/10.1111/j.1468-1293.2006.00393.x [Link]
17. Tirard V, Niel G, Rosenheim M, et al. Diagnosis of toxoplasmosis in patients with AIDS by isolation of the parasite from the blood. The New England Journal of Medicine. 1991;324:632.
18. Belanger F, Derouin F, Grangeot K, Meyer L, and the HEMOCO and SEROCO Study Groups. Incidence and risk factors of toxoplasmosis in a cohort of human immunodeficiency virus-infected patients: 1988-1995. Clinical Infectious Diseases.1999;28(3):575-581. http://dx.doi.org/10.1086/515147. [Link]
19. Rabaud C, May T, Amiel C, et al. Extracerebral toxoplasmosis in patients infected with HIV. A French National Survey. Medicine.1994;73(6):306-314.
20. Kovari H, Ebnother C, Schweiger A, Berther N, Kuster H, Gunthard HF. Pulmonary toxoplasmosis, a rare but severemanifestation of a common opportunistic infection in late HIV presenters: Report oftwo cases. Infection. 201 0;38:1 41 -1 44. http://dx.doi.org/10.1007/s15010-009-9367-5 [Link]
21. Ganji M, Tan A, Maitar MI, Weldon CM, Weisenberg E, Rodano DP Gastric toxoplasmosis in a patient with Acquired Immunodeficiency Syndrome. A case report and review of the literature. Archives of Pathology Laboratory Medicine. 2003;127:732-734.
22. Seguro FS, Assis RA, Silveira PA, Bezerra AM. Images in haematology. Toxoplasma gondii in the bone marrow after pancreas-kidney transplantation. British Journal of Haematology. 2009; 1 47(3):276. http://dx.doi.org/10.1111/j.1365-2141.2009.07680.x. [Link]
